Как обмануть смерть и рак
Человеческое тело невероятно живуче. Столкнувшись с болезнью или инфекцией, оно адаптируется, чтобы сохранить жизнь. При большинстве заболеваний тело чувствует себя лучше или хуже в зависимости от того, прогрессирует недуг или находится в ремиссии. Рак – одна из очень немногих болезней, которая бывает агрессивной и может перехитрить даже самое живучее тело. Как с раком ни борись, он становится лишь еще враждебнее, а шансы, что противораковая терапия поможет, становится все меньше. С другой стороны, в детском возрасте рак обычно излечим. Так что где-то есть «тумблер», который отличает слабые виды рака, которых можно победить, от сильных и выносливых, которые рано или поздно убивают человека. В возрасте от 25 до 50 лет люди заболевают раком сравнительно редко. Будущие исследования, скорее всего, установят причины этого и, может быть, найдут новые способы терапии, которые превратят смертоносные раки в слабые, которые можно победить. Или же рак можно будет каким-то образом отправить на «карантин» и сдерживать лекарствами, чтобы он не нанес вреда телу.
В прошлом я не раз критиковал свою отрасль медицины за отсутствие прогресса в области разработки методов лечения, которые могут замедлить развитие рака или вообще его предотвратить. Но сейчас наконец-то появилась надежда – благодаря новым технологиям: секвенированию опухолей и молекулярному таргетированию раковых опухолей препаратами, которые, по сути, отключают «тумблеры», заставляющие клетки идти вразнос. Это позволяет выгадать самое ценное, что у нас есть: время. Для смертельно больного пациента важны даже несколько лишних недель или месяцев – особенно если вот-вот должна появиться новая терапия. Сейчас молекулярное таргетирование используется намного чаще, чем в то время, когда мы применяли его для лечения Стива Джобса, но оно работает не во всех случаях: на данный момент оно помогает примерно 20–30 % больных всеми видами рака. Кроме того, оно может быть очень дорогим, но я предполагаю, что это вскоре изменится: различные экономические силы приведут к снижению цен. Чтобы лучше понять, как работает молекулярное таргетирование, посмотрите на следующий рисунок. Этот конкретный пример предоставила компания Foundation Medicine, занимающаяся секвенированием ДНК опухолей [10].
Вы видите результаты секвенирования опухоли у пациента с раком легких. Такие отчеты я получаю, когда отправляю частицы раковых тканей на исследование и генетическое секвенирование. Не пытайтесь даже понять абракадабру, которую мы используем для обозначения генов. Сосредоточьтесь на результатах: пять геномных мутаций, или изменений в четырех целевых генах, оказались связаны с раком легких у этого пациента.

Отчет о секвенировании генов опухоли у пациента с продвинутой стадией рака легких.
Образец рака, который используют для секвенирования, берут из так называемого парафинового блока; по сути, это очень тонкий «ломтик» рака, извлеченный из пациента и помещенный в вязкий материал (парафин). Там его хранят после операции; прежде чем отдать на генетическое тестирование, его исследует патологоанатом.
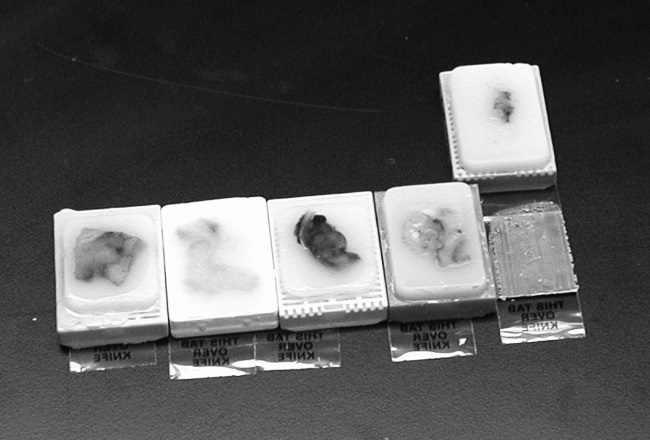
Группа парафиновых блоков с закрепленными внутри кусочками опухолей.
У каждого больного раком есть такой парафиновый блок – образец опухоли, по которому был установлен первоначальный диагноз. Следующее изображение – снимок биопсии легкого. В данном случае для забора образца опухоли используется игла.
Затем из этого образца изолируется и секвенируется ДНК. Сравнивая ДНК из клеток биопсии со здоровыми клетками пациента, мы узнаем, какие изменения ДНК сделали клетку раковой. Это «тумблеры», которые включили рак. А теперь давайте вернемся к результатам секвенирования.
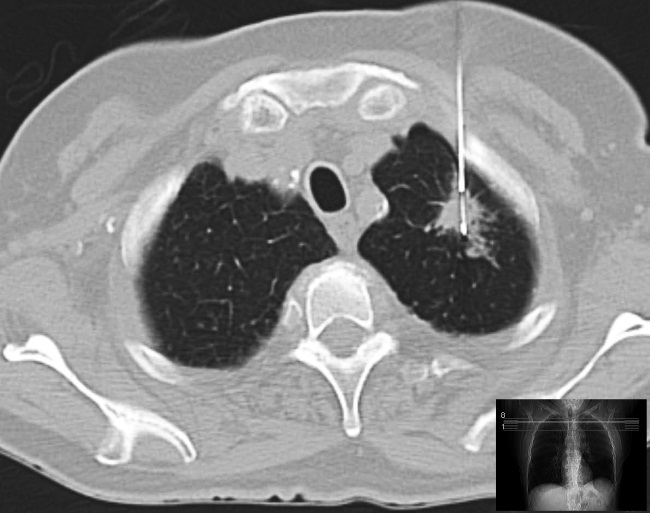
Компьютерная томография процесса биопсии легкого, проведенного по подозрению на рак легких. Справа – игла, входящая в легочную массу. Небольшое изображение внизу справа показывает, где именно сделан большой снимок (в том месте, где линия пересекает пациента).
Для одной из целей, гена киназы анапластической лимфомы (ALK), существует лекарство, одобренное FDA. Это лекарство просто великолепно помогает, но только тем пациентам, у которых этот ген изменен. Еще одна хорошая новость для секвенированного здесь рака состоит в том, что пациент не только может попробовать, по крайней мере, одну существующую терапию, но и записаться на десять разных клинических испытаний – это возможности попробовать другие лекарства, действие которых на этот тип рака пока проверяется.
Если человек болен, для него важно прожить день, неделю, несколько месяцев. Потому что испытания новых препаратов идут непрерывно, и новое лечение может появиться вот-вот. Например, сейчас молекулярное таргетирование используется намного чаще, чем тогда, когда его применили для лечения Стива Джобса, и на данный момент оно помогает уже 20–30 % больных.
Вы можете узнать все о любых клинических испытаниях, проводящихся сегодня, зайдя на сайт clinicaltrial.gov. Там вы увидите, на какие испытания все еще приглашают новых пациентов и как на них записаться. Клинических испытаний не нужно бояться: они очень важны для поиска новых решений и определения, какие лекарства каким людям помогают – даже если сами они помогают лишь небольшому числу пациентов. Конечно, в будущем мы сможем улучшить качество клинических испытаний, чтобы их результаты имели большее значение для большего числа людей, а также успешность разработки лекарств и новых методов лечения. Не стоит забывать, что клинические испытания новых лекарств или методов лечения и ухода проводятся только после того, как они будут проверены в лаборатории – на клетках и животных-моделях. Самые многообещающие методы, обнаруженные в ранних экспериментах, затем изучают на людях с помощью тщательно контролируемых испытаний, которые следуют строжайшему протоколу в течение нескольких этапов. Для любого клинического испытания существуют так называемые критерии приемлемости, которые строго определяют, кто может в нем участвовать, а кто – нет. Это гарантирует наиболее надежные результаты, потому что участники должны быть похожи друг на друга по ключевым параметрам: возраст, пол, конкретная болезнь, прошлые методы лечения, состояние здоровья. Цели различных этапов испытания, в зависимости от вопросов, на которые мы пытаемся ответить, могут быть следующими: показать, что новый метод лечения безопасен, работает лучше, чем уже имеющиеся, или обладает меньшим количеством побочных эффектов, чем стандартная терапия.
Все клинические испытания в США должны пройти оценку экспертного совета. Это независимый комитет профессионалов, включающий в себя врачей, ученых, статистиков и адвокатов пациентов; его задача – защищать права, безопасность и благополучие участников клинического испытания и минимизировать риски. Пациенты, дающие согласие на испытание, должны быть полностью информированы и защищены.
Лучшие испытания «рандомизируются»: одна группа получает экспериментальное лекарство, другая – стандартное общепринятое лечение. Это позволяет нам сравнивать новую терапию с уже имеющейся. Кроме того, рандомизация гарантирует, что все участники получат либо новое экспериментальное лечение, либо стандартное. В «двойном слепом» исследовании ни пациенты, ни врачи не знают, какое именно лечение получает пациент; это повышает степень доверия к результатам, потому что ученые при этом обычно менее пристрастны в своих оценках. Если вы участвуете в рандомизированном и «двойном слепом» клиническом испытании, то вам об этом сообщают через процесс информированного согласия, и уже после этого вы решаете, участвовать или нет.
Меня часто спрашивают о плацебо: многие пациенты, фантазирующие, как им дадут на клиническом испытании новейшее суперлекарство, боятся, что их отправят в группу плацебо и они ничего не получат. Плацебо – это «пустые пилюли»: внешне они выглядят точно так же, как таблетки, которые изучаются на испытании, но при этом не оказывают никакого действия. (Плацебо могут быть не только таблетками, но и, например, жидкостями или порошками; главное – чтобы они внешне были неотличимы от экспериментального лекарства.) На самом деле в большинстве клинических испытаний, связанных с раком, плацебо мы не используем. Но в некоторых испытаниях плацебо используют, и не зря: иногда это единственный способ определить, работает новый подход или новое лекарство или нет. В этих случаях участников всегда предупреждают через процесс информированного согласия. К тому же любое испытание в любой момент можно прервать, если одна группа показывает значительно лучшие результаты, чем другая. Именно так произошло в апреле 1998 года во время испытаний противоракового препарата тамоксифена. Когда врачи обнаружили, что у женщин из группы риска, участвовавших в испытании по профилактике рака груди, проводимом Национальным институтом рака, при приеме тамоксифена количество случаев рака уменьшилось на 45 процентов, участницам, принимавшим плацебо, тут же предложили перейти на прием настоящего лекарства.
Теперь вернемся к генетическому профилю пациента с раком легких. Это не мой пациент, но я могу привести немало примеров из собственного опыта, которые показывают не только эффективность лекарств в борьбе с раковыми клетками, но и важность дозировки. Нижеприведенная история реальна, но я изменил имя пациента – назовем его Рик. Во введении я вкратце упоминал эту историю.
У Рика рак легких – опухоль, содержащая тот же измененный ген ALK, на который воздействует лекарство церитиниб (зикадия) и еще несколько средств. Поначалу опухоль, пошедшая метастазами по всему телу, прекрасно реагировала на лечение одним из лекарств, нацеленных на ALK. Но со временем, как часто бывает со скрытными видами рака, некоторые клетки смогли избежать лекарства и добрались до его мозга, где тоже стала расти опухоль. В остальном теле рак уже не разрастался и по-прежнему поддавался лечению.
Обсуждая его случай с коллегами, я спросил, что же теперь делать, чтобы бороться с раком. Мое «оружие» не добиралось до мозга Рика из-за гемато-энцефалического барьера, защищающего орган от чужеродных молекул. Эта «стена» должна изолировать мозг, но в данном конкретном случае приносила пациенту вред: она впустила рак, но не пропускала противораковое лекарство. Некоторые коллеги предложили давать лекарство не каждый день, а через день, но большими дозами – в надежде, что оно сможет все-таки «пробить» гемато-энцефалический барьер и попасть в мозг. Я опять-таки действовал вслепую, но терять было нечего, так что я попробовал предложенный способ, и он сработал. На тот момент, когда я пишу эти строки, Рик все еще остается одним из лидеров огромной компании и по-прежнему работает каждый день – почти через четыре года после постановки диагноза «рак легких». Правильное лекарство в правильных дозах может спасти жизнь.
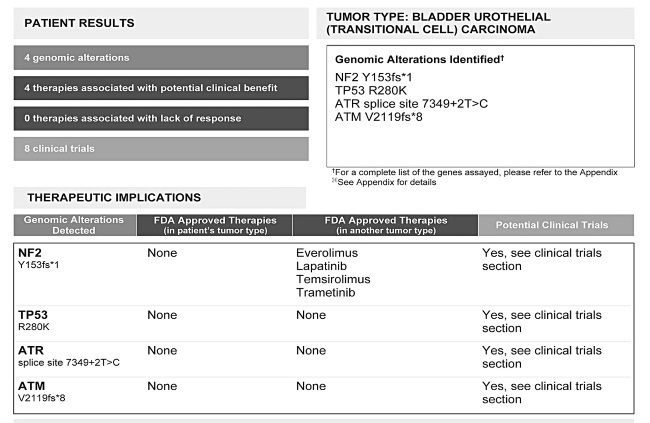
Отчет о секвенировании генов опухоли у пациента с продвинутой стадией рака мочевого пузыря.
Давайте посмотрим на результат еще одного молекулярного теста; у этого пациента рак мочевого пузыря.
Судя по молекулярному тесту, у пациента есть надежда: обнаружено четыре генетических дефекта, связанных с раком, и для одной из мутаций существуют четыре терапии, одобренные FDA. Они могут помочь, правда, эти лекарства одобрены для применения при других видах рака. И, хотя для трех других мутаций известных терапий не существует, сейчас идут клинические испытания, к которым он (или она) может присоединиться. Хочу указать, что, если лекарство не одобрено FDA для лечения конкретной болезни или состояния, это не значит, что врач не может прописать его «не по инструкции». Сразу внесу ясность: если лекарство применяется не по инструкции, это отнюдь не всегда значит, что оно опасное или непроверенное. Некоторые лекарства применяются не по инструкции только потому, что фармацевтические компании решили не тратить дополнительные деньги и усилия, необходимые, чтобы получить одобрение FDA на применение лекарства против определенной болезни – особенно когда речь заходит о редких заболеваниях, которыми страдает лишь горстка людей.
Многие методы лечения рака – это как раз использование «не по инструкции» лекарств, одобренных FDA. Например, многие комбинационные терапии, с помощью которых мы лечим лимфому, рак груди и рак кишечника, не одобрены FDA для лечения именно этих конкретных раков. Лекарства, применяемые не по инструкции, могут помочь многим пациентам, но их не всегда оплачивают страховые компании. Представьте ситуацию: этот пациент с раком мочевого пузыря получает из лаборатории вышеприведенный анализ. Его врач, изучив генетический профиль, рекомендует ему лекарство, но страховая компания говорит, что не будет его оплачивать, а лекарство стоит 100?000 долларов в год или даже больше. В онкологии сейчас такое встречается сплошь и рядом.
Когда-то каждый год появлялась лишь жалкая горстка новых лекарств, но сейчас даже в моей отрасли они поставлены практически на поток. За последние десять лет таргетная терапия лекарствами вроде иматиниба (гливек) и трастузумаба (герцептин) стала стандартом в лечении нескольких видов рака. Эти лекарства атакуют клетки рака, наводясь на специфические молекулярные изменения, заметные только в этих клетках. Сейчас на сцену вышла еще и иммунотерапия, которая позволяет выиграть несколько месяцев, а иногда и лет, так что в скором времени медицина войдет в новую фазу, когда сами клетки станут живыми «лекарствами». Это назвали третьим столпом медицины [11]. Лекарства, полученные благодаря синтетической химии, были первым столпом. Затем, когда в 1978 году компания Genentech научилась производить инсулин в бактериях, случилась революция белковых лекарств. Теперь же лекарственные компании надеются использовать в качестве лекарств наши собственные клетки. В случае с Т-лимфоцитами вообще есть чуть ли не неопровержимые доказательства, что некоторые раки с их помощью можно вылечить вообще без побочных эффектов, за исключением высокой температуры. И если эти результаты будут подтверждены, то тестирование генно-модифицированных Т-лимфоцитов для лечения рака крови может привести к довольно быстрому одобрению этого метода лечения со стороны FDA. Возможно, понадобится всего семь лет, тогда как в среднем для одобрения нового лекарства требуется почти четырнадцать.
Еще одна хорошая новость: более быстрый доступ к экспериментальным лекарствам означает, что они успеют помочь большему числу людей, страдающих серьезными или опасными для жизни заболеваниями. В 2015 году FDA упростило процесс приобретения врачами подобных лекарств; раньше доктор тратил сотню часов, заполняя все формы, необходимые для подачи заявки на экспериментальное лечение, сейчас же на все тратится не больше часа. Не каждый пациент, который хочет лечиться экспериментальным лекарством, может его получить. Пациент имеет право на экспериментальное лечение только в том случае, если нет никаких других известных способов диагностировать или лечить его болезнь и у него нет возможности поучаствовать в клиническом испытании экспериментального лекарства. Кроме того, требуется оценить риск и продемонстрировать, что вероятный риск от болезни выше, чем вероятный риск от экспериментального лекарства. Наконец, доктор должен гарантировать, что производитель лекарства готов его предоставить. FDA не может заставить производителя выдать лекарство кому бы то ни было; агентство лишь устанавливает правила выдачи. FDA удовлетворяет подавляющее большинство заявок в течение нескольких дней или даже часов.
Впрочем, в будущем фармацевтическим компаниям все равно придется отвечать на много трудных вопросов, и первый из них – ценообразование. В нынешней системе каждая таблетка или укол обладают определенной стоимостью. Чем дольше пациент получает лечение, тем дороже оно стоит. Таким образом, затраты размываются по долгому периоду. Но вот новые лекарства, возможно, придется давать всего один раз, и, соответственно, у фармацевтических компаний будет, так сказать, «единственная возможность» получить прибыль. Какую цену назначать за такое лечение? Никто пока еще не знает, как персонализированную клеточную терапию можно вывести на масштабный коммерческий уровень. Когда-нибудь, возможно, мы сможем, например, поставить на поток иммунотерапию и производство Т-лимфоцитов или даже заниматься генной инженерией прямо у постели пациента, причем так, чтобы не обанкротился ни пациент, ни компания – производитель Т-лимфоцитов. Некоторые лаборатории работают над инструментами, вводящими генетический материал в клетки с помощью электрических разрядов или давления. Другие показали, что уже умеют выращивать Т-лимфоциты в чашке Петри и с их помощью лечить мышей, то есть, возможно, в скором времени появятся целые фабрики Т-лимфоцитов. Сейчас, впрочем, во всех клинических испытаниях для производства Т-лимфоцитов используются собственные клетки пациента, а процесс создания этих особых клеток трудоемок и дорог.

Ни одно из этих препятствий не кажется непреодолимым. Более того, они, может быть, даже помогут нам лучше узнать о человеческом теле и о болезнях вроде рака, когда мы станем развивать новые технологии и искать способы снизить их стоимость.
В 1970 году Ричард Пето, британский эпидемиолог, показавший научному миру важность метаанализа, и ведущий эксперт по смертям, связанным с курением табака, сформулировал парадокс, названный его именем. Парадокс Пето звучит так: размер животного никак не коррелирует с его заболеваемостью раком. Слон в восемьдесят раз больше человека, соответственно, и клеток у него во столько же раз больше, но слоны болеют раком очень редко. То же можно сказать о китах и вымерших мамонтах.
Это кажется совершенно нелогичным, потому что чем больше в организме клеток, тем выше вероятность мутации и, соответственно, образования раковой опухоли. Так что этот феномен вызывается каким-то другим процессом – и в 2015 году мы наконец-то узнали, в чем может быть дело: две команды ученых независимо друг от друга обнаружили, что в слоновьих клетках 20 копий (40 аллелей) гена p53 – знаменитого ныне гена, связанного с защитой от рака. У людей всего одна копия (2 аллели) этого гена [12]. Более того, ген p53 даже называют «хранителем генома» [13]. Именно так мы называем ген, подавляющий опухоли. У него три известные функции:
1) он запускает механизмы репарации ДНК, когда чувствует, что ДНК отклонилась от первоначального генома;
2) он останавливает деление клеток, обнаружив изменения в ДНК, что делает ремонт ДНК более эффективным;
3) он запускает механизм клеточного саморазрушения, когда в ДНК слишком много мутаций и исправить их невозможно.
Большинство опухолей у людей связано с мутацией в одной или обеих аллелях гена p53. Потеря одной из аллелей приводит к синдрому Ли – Фраумени: риск заболеть раком повышается более чем до 90 %, первичных опухолей возникает сразу несколько, причем рак может развиться уже в раннем детстве. Хотя пока еще точно не доказано, что дополнительные гены p53 повышают сопротивляемость слонов к раку, новые исследования, которые, возможно, это подтвердят, могут привести к созданию новых лекарств, имитирующих работу гена p53, и новых методов профилактики рака у людей.
Меня часто обвиняют в том, что я отношусь к любым открытиям в медицине с детским восторгом. Я радуюсь малейшим, самым тривиальным научным открытиям, заслуживающим публикации в престижном журнале, но при этом совершенно не интересным среднему человеку, потому что они ничего не лечат. Один из примеров – как раз разница в количестве генов p53 у людей и слонов. Но многие просто не понимают, что такие маленькие победы, незначительные с виду моменты, когда мы тихо кричим «Эврика!», на самом деле – нечто намного большее, чем сумма отдельных составных частей. Они цепляются одна за другую и шаг за шагом подводят нас все ближе к лекарствам, в которых мы так отчаянно нуждаемся.