Исправление помарок в ДНК
Дуглас Тёрнбулл – профессор-невролог в Ньюкаслском университете (Великобритания), где занимается исследованиями и возглавляет Центр митохондриальных исследований Фонда Уэлкома. После многолетних наблюдений за пациентами с неизлечимыми и иногда смертельными митохондриальными болезнями, в том числе Шерон Бернарди и ее детьми, он поклялся найти способ предотвратить передачу митохондриальных расстройств вроде синдрома Лея по наследству. Впервые он заинтересовался митохондриальными болезнями еще сорок лет назад, когда работал в неврологическом отделении и познакомился с пациентом из Королевских ВВС, жаловавшимся на мышечную слабость во время тренировочных полетов. Тёрнбулл ошибся, предположив, что у этого конкретного пациента митохондриальная болезнь, но тема его очень заинтересовала. Он получил степени доктора медицины и кандидата биологических наук; кандидатскую диссертацию он защитил на тему молекулярных механизмов митохондриальных заболеваний. Всю свою карьеру он пытается понять, как эти жизненно важные маленькие структуры, живущие своей жизнью внутри клеток, начинают работать не так, как следует.
Именно Тёрнбулл обнаружил, что Шерон носит в себе мутировавшие митохондрии, когда познакомился с ней в середине 90-х и сделал ей биопсию мышц. Он удивился, что Шерон так прекрасно выглядит, но вовсе не удивился, узнав, что многие члены ее семьи страдают от серьезных проблем со здоровьем. У самой Шерон проблемы начались в возрасте тридцати пяти лет. У ее матери в возрасте за пятьдесят начались проблемы с сердцем. Тёрнбулл твердо вознамерился не дать детям унаследовать плохие митохондрии.
Доктор Тёрнбулл не был первым, кто захотел избавиться от мутировавших митохондрий. В 80-х годах эмбриологи, работавшие с мышами, начали исследовать различные методы подобных «избавлений». В конце концов, они открыли процедуру, которая сейчас называется «методом цитоплазматической замены»: генетический материал из ядра яйцеклетки женщины с мутировавшими митохондриями (23 пары хромосом) переносят в яйцеклетку другой, здоровой женщины. Эта процедура уничтожает дефектные митохондрии, сохраняя при этом хромосомную ДНК биологической матери. Процедуру можно выполнить двумя способами (см. далее).
Тёрнбулл и другие ученые экспериментировали с этой методикой на обезьянах, мышах и человеческих яйцеклетках в культуре. В 2009 году сотрудник Орегонского университета здравоохранения и естественных наук в Бивертоне, биолог-исследователь стволовых клеток и репродуктивного здоровья Шухрат Миталипов с коллегами объявил о рождении двух здоровых макак-резусов, ядерные и митохондриальные ДНК которых были получены из разных яйцеклеток. В пять лет они по-прежнему оставались вполне здоровыми. Миталипов и его команда продемонстрировали свою процедуру и в человеческих яйцеклетках: они создали эмбрионы, развившиеся в сформированные бластоцисты – клеточные массы из 50–200 стволовых клеток, которые потенциально могут сформировать любые ткани тела. Эти бластоцисты можно трансплантировать в матку женщины. Сейчас команда Миталипова готовится протестировать свой метод на людях.
У этих процедур есть свои критики – по очевидным причинам. Могут ли подобные методики привести к непредвиденным последствиям? Например, могут ли они вызвать небольшие изменения на молекулярном или генетическом уровне, которые мешают нормальному развитию или вызывают проблемы со здоровьем на склоне лет? Это возможно, если окажется, что митохондриальный и ядерный геномы людей, зачатых с помощью цитоплазматической замены, по какой-либо причине несовместимы между собой. Чтобы митохондрии функционировали как следует, митохондриальные гены должны быть совместимы с собственной ДНК человека. Генетические вариации в обеих структурах, скорее всего, развивались вместе. Несколько исследований показали, что замена митохондрий у мышей, дрозофил и других организмов иногда приводит к проблемам с дыханием, деторождением и когнитивными навыками. Как мы можем быть уверены, что эта методика безопасна для всех участников? Ставит ли эта технология нас на край пропасти, с которого легко можно рухнуть в производство «дизайнерских детей»?
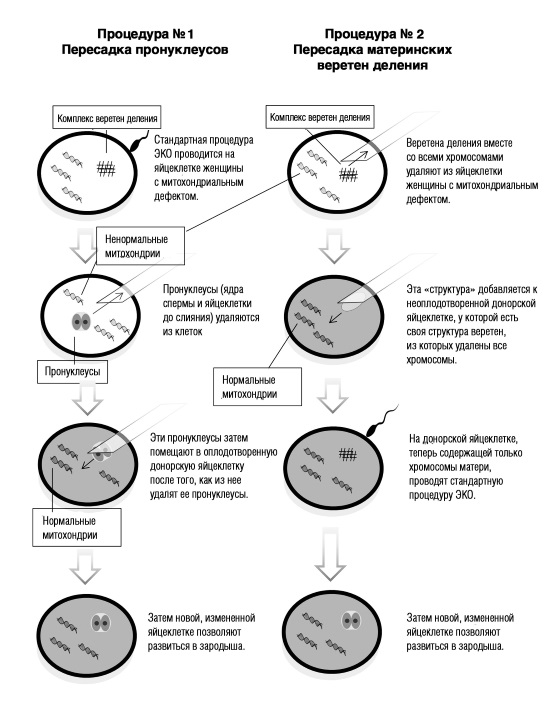
Эта диаграмма показывает две процедуры, способные соединить больную яйцеклетку со здоровой, чтобы предотвратить редкие, но разрушительные митохондриальные болезни.
По сравнению с тем, что происходит в Великобритании, мы в США намного отстали и в обсуждении этих разработок, и в вопросе того, как их регулировать на национальном и глобальном уровнях. Тем не менее сама технология – уже на кончиках наших пальцев. Она существует дольше, чем кто-либо из нас себе представляет; даже FDA пришлось догонять практику. С 2001 года FDA требует от исследователей получать разрешения на пересадку митохондрий. Это произошло после того, как клиника репродуктивного здоровья в Нью-Джерси провела несколько процедур по пересадке цитоплазмы (и некоторых митохондрий) между человеческими яйцеклетками, чтобы женщины смогли зачать. Процедуры были проведены в середине 90-х, в то же время, когда Шерон Бернарди оплакивала своих умерших детей, а ее врачи, наконец, начали понимать, что же происходит. Специалист по фертильности по имени Жак Коэн, работавший тогда в Медицинском центре св. Варнавы в Ливингстоне, Нью-Джерси, провел эксперимент, результатом которого стала пересадка митохондрий. В то время он пытался вылечить нескольких женщин, которые не могли зачать самостоятельно. У этих женщин были яйцеклетки, еще достаточно молодые, чтобы из них развились здоровые дети, но вот цитоплазма вокруг ядер их яйцеклеток выглядела не очень хорошо.
Цитоплазма клетки – это вязкая, похожая на гель жидкость, окружающая ядро и замкнутая клеточной мембраной. Она примерно на 80 % состоит из воды и включает в себя весь материал, находящийся внутри клетки, но снаружи ядра, в том числе и митохондрии. У бесплодных пациенток Коэна цитоплазма выглядела раздробленной и заполненной какими-то «обломками»; тогда он задался вопросом, что произойдет, если добавить немного цитоплазмы из здоровой яйцеклетки другой женщины, «омолодив» таким образом яйцеклетки пациенток.
После того как первый эксперимент на мышах сработал, он проверил методику на людях в 1997 году, «омолодив» яйцеклетки 33 бесплодных женщин путем осторожного впрыскивания цитоплазмы из яйцеклетки другой женщины. Через девять месяцев родилось 17 детей. Коэн знал, что пересаженная цитоплазма, скорее всего, содержит «клеточные батарейки, которые называют митохондриями» и которые поддержат развитие плода. Но, скорее всего, он и не подозревал, что его команда изменяет митохондриальную ДНК каждой из этих яйцеклеток. Они стали первопроходцами в деле изменения генетического наследия человека и создания первых в мире генетически модифицированных людей. В 2001 году анализы подтвердили, что, по крайней мере, двое детей получили митохондрии из двух источников: от донора цитоплазмы и от биологической матери.
Что произошло – и что произойдет – с этими детьми? Мы не знаем всех возможных последствий для здоровья. Опыты на мышах показывают, что подобное смешивание митохондрий может привести к непредвиденным последствиям. У мышей к старости развивается ожирение и гипертония, они страдают от когнитивных нарушений. У одного из детей, родившихся у пациенток Коэна, развилось расстройство аутистического спектра, а у двух плодов (у одной пациентки случился выкидыш, другая сделала аборт) обнаружился серьезный генетический дефект, известный как синдром Тёрнера. Являются ли эти дефекты прямым последствием процедуры, пока неизвестно. Команда Коэна перестала делать пересадку цитоплазмы в 2001 году, когда FDA обратило на них внимание и сообщило, что требуется больше данных исследований, прежде чем эту операцию можно будет безопасно применять на людях.
В 1997 году впервые был проведен эксперимент по созданию генетически модифицированного человека. Правда, ученые даже не предполагали, что их борьба с бесплодием имеет отношение к изменению генома человека.
Эти 17 детей сейчас – подростки, и за ними не велось никакого формального наблюдения. Коэн работает директором лаборатории в Reprogenetics, компании из Ливингстона, занимающейся преимплантационной генетической диагностикой; он разыскивает этих детей, чтобы узнать, что с ними случилось, готовы ли они назвать себя и пройти обследование. Коэн и его команда надеются, что их открытия помогут добиться серьезного прогресса в этой области медицины и вывести дебаты на новый уровень ради всех нас.
От идеи, что мы можем редактировать свои гены и даже изменить весь геном будущих поколений, Дарвин бы перевернулся в гробу: именно он предположил, что природа отбирает лучшие гены, чтобы они жили и размножались, что природа, а не люди-инженеры должна служить верховным судьей. Мне даже иногда интересно, что бы он подумал о ценности секвенирования ДНК, зная, что оно не дает полной картины или, хуже того, приводит к непредвиденным последствиям вроде совершенно необязательной операции или дорогого, болезненного лечения.