2.4. Особенности профилактики наследуемых заболеваний
Для наследственных болезней и болезней с наследственным предрасположением необходимым звеном в первичной и вторичной профилактике является медико-генетическое консультирование. Прогресс медико-генетического консультирования обусловлен раскрытием генетической природы многих наследственных болезней и возможностью их пренатальной (дородовой) диагностики. Кроме того, ведущее место в общей структуре заболеваемости и смертности заняли мультифакториальные болезни с наследственным предрасположением: сердечно-сосудистые, онкологические, эндокринные, ревматологические и многие другие. Это определяет актуальность и необходимость генетических подходов к выявлению многочисленных, ассоциированных с наследственностью и индивидуальными генетическими особенностями, этиопатогенетических и клинических факторов, к поиску путей для предупреждения заболеваний, представляющихся сегодня полиэтиологическими и малокурабельными.
Медико-генетическое консультирование – вид специализированной медицинской помощи населению, главной целью которого является профилактика заболеваний, включающих в этиологию генетические факторы.
Основные задачи медико-генетического консультирования можно сформулировать следующим образом:
1) определение прогноза здоровья будущего потомства в семьях, где был, есть или предполагается больной с наследственной патологией;
2) объяснение родителям в доступной форме смысла генетического риска и помощь в принятии решения;
3) оказание помощи врачам в постановке диагноза наследственной болезни, если для этого требуются специальные генетические методы исследования;
4) диспансерное наблюдение и выявление групп повышенного риска среди родственников больного с наследственной патологией;
5) пропаганда медико-генетических знаний среди врачей и населения.
Особенности проявлений наследственных болезней
Число нозологических единиц наследственных болезней огромно, клинические проявления их так разнообразны, что приходится использовать знания врачей разных специализаций для постановки конкретного диагноза. Между тем можно выделить некоторые общие, характерные для наследственных болезней черты.
Заподозрить наследственный характер помогает врачу наличие у нескольких родственников однотипных проявлений болезни. В семейных случаях болезни необходимо провести дифференциальную диагностику конкретной наследственной болезни.
Наследственные болезни могут начинаться в любом возрасте, однако они всегда протекают хронически с устойчивым прогрессированием патологического процесса. Стабильное действие мутантного гена предопределяет хроническое течение заболевания. Взаимодействие генотипических особенностей и внешних факторов (инфекции, охлаждения и пр.) приводит к рецидивам заболевания и осложнениям клинической картины.
Например, длительные расстройства пищеварения возникают при целиакии, кишечной форме муковисцидоза, дисахаридазной недостаточности.
Наличие у больного редко встречающихся специфических симптомов или их сочетаний позволяет заподозрить наследственный или врожденный характер болезни.
Например, астеническое телосложение с измененной грудной клеткой, подвывих хрусталика позволяют заподозрить наличие синдрома Марфана; при кровоточивости можно думать о болезни фон Виллебранда или гемофилии и т. п.
Первичное вовлечение в патологический процесс многих органов и систем позволяет предположить наследственный характер заболевания. Это связано с плейотропным свойством гена (плейотропность – когда действие одного мутантного гена вызывает вовлечение в патологический процесс многих органов и систем).
Например, мутантные аллели генов, контролирующих синтез коллагена и фибриллина, приводят к нарушению свойств волокнистой соединительной ткани. Соединительная ткань – основа всех органов и тканей, в связи с чем понятны множественные влияния этих мутаций на клиническую картину (фенотип) при таких наследственно обусловленных болезнях, как синдром Элерса – Данлоса, синдром Марфана. Для этой группы болезней особенно характерно: нарушение строения сосудистой стенки (особенно аорты), подвывих хрусталика, пролапс митрального клапана, гиперрастяжимость кожи, гипермобильность суставов, изменения опорно-двигательного аппарата.
Врожденный характер заболевания не всегда свидетельствует о наследственной природе патологического процесса. Аллели – нормальные и патологические – приступают к функционированию в разные периоды жизни: от эмбрионального до старческого. Вместе с тем не менее 25 % генных болезней и почти все хромосомные синдромы начинают формироваться внутриутробно.
Одной из особенностей наследственных болезней является устойчивость (резистентность) к обычным методам лечения. Однако при выяснении патогенеза заболевания, установлении биохимического дефекта разрабатываются и успешно применяются специальные методы лечения, поэтому некоторые устойчивые к терапии болезни переходят в группу поддающихся лечебным мероприятиям.
Сущность генетического прогноза
В соответствии с задачами поводом для направления на генетическую консультацию служат следующие ситуации:
1) диагноз наследственной болезни поставлен, и пробанд, и его родственники хотят знать прогноз для будущего или уже имеющегося ребенка;
2) наследственная болезнь подозревается, и для уточнения диагноза требуются генетические методы исследования;
3) рождение больного ребенка в семье предполагается по тем или иным причинам (родственный брак, прием лекарственных препаратов, потенциально опасных для вынашивания и ребенка и др.).
Врач должен заподозрить наследственную патологию и направить семью в медико-генетическую консультацию в следующих случаях:
1) наличие аналогичных заболеваний или симптомов у нескольких членов семьи;
2) отставание в умственном и физическом развитии;
3) наличие диспластических черт развития в сочетании с другими патологическими признаками (например, низкий рост, судорожный синдром, алалия и др.);
4) врожденные пороки развития;
5) первичное бесплодие супругов;
6) первичная аменорея;
7) привычное невынашивание беременности;
8) непереносимость лекарственных препаратов и пищевых продуктов;
9) кровное родство родителей.
Сущность генетического прогноза состоит в оценке вероятности появления наследственной патологии у будущих или уже родившихся детей. Консультации по прогнозу можно разделить на две группы:
1) проспективное консультирование;
2) ретроспективное консультирование.
Проспективное консультирование – это наиболее эффективный вид профилактики наследственных болезней, когда риск рождения больного ребенка определяется еще до наступления беременности или на ранних ее сроках. Ретроспективное консультирование – это консультирование после рождения больного ребенка в семье относительно здоровья будущего потомства.
Главным условием при расчете генетического риска является точный диагноз и знание конкретной ситуации в семье. Существует два основных принципа оценки генетического риска на основе:
1) теоретических расчетов, исходя из законов Менделя;
2) эмпирических данных.
Конечный эффект медико-генетического консультирования определяется не только точностью заключения консультанта, но и, в большей степени, пониманием консультирующимся смысла генетического прогноза. В дальнейшем семья самостоятельно принимает приемлемое для нее решение в отношении будущего потомства. С генетической точки зрения, риск до 5 – 10 % – низкий, риск 10 – 20 % – средний, риск более 21 % – высокий.
Пренатальная диагностика наследственных болезней
Пренатальная (дородовая) диагностика при медико-генетическом консультировании имеет исключительное значение, поскольку она позволяет перейти от вероятностного к однозначному прогнозированию здоровья ребенка.
Пренатальная диагностика осуществляется с помощью различных методов исследования, применяемыхвIиIIтриместрах беременности, то есть в периоды, когда в случае обнаружения патологии еще возможно прерывание беременности.
Методы пренатальной диагностики представлены в основном неинвазивными подходами: ультразвуковое исследование, эхография (проводятся на 16 – 26-й неделях беременности). С помощью этих методов можно не только установить размеры плода, но и диагностировать различные пороки развития. Определение концентрации в сыворотке крови матери ?-фетопротеина и других маркеров (хорионического гонадотропина и неконъюгированного эстриола) позволяет выявить части случаев синдрома Дауна, дефекты нервной трубки и др. По показаниям применяются инвазивные методы пренатальной диагностики (амниоцентез, биопсия хориона, кордоцентез).
Консультирование при хромосомных болезнях
Следует отметить, что большинство хромосомных болезней имеет крайне низкий повторный риск в семьях, так как они являются, главным образом, результатом новой мутации. При хромосомных болезнях в практике генетического консультирования используется особый подход к расчету риска. Существуют таблицы эмпирического риска при хромосомных болезнях, которые приводятся в специальной литературе.
Определение риска проводится в основном в трех ситуациях:
1) повторное рождение детей с анеуплоидией при нормальном кариотипе родителей;
2) повторное рождение больного при мозаицизме у одного из родителей;
3) прогноз при носительстве сбалансированных перестроек одним из родителей.
Поскольку существует возможность пренатально определить кариотип плода (тем самым получить точный диагноз у плода), важно правильно оценить ситуацию, когда риск повторения рождения больного ребенка с хромосомной аномалией высок или когда риск повторения крайне мал. Вместе с тем следует помнить, что с увеличением возраста матери риск рождения ребенка, например, с болезнью Дауна, повышается. Возраст отца практически не оказывает влияния на трисомии у ребенка.
Консультирование при моногенных болезнях с разным типом наследования
Все расчеты медико-генетического консультирования при моногенных болезнях основаны на применении законов Менделя и элементов теории вероятности. Моногенные болезни по основным типам наследования делятся на: аутосомно-доминантные, аутосомно-рецессивные и сцепленные с хромосомой Х (доминантные и рецессивные).
Выработанные на основе анализа рекомендации должны касаться не только конкретной патологии, но и носить значительно более развернутый характер. Они могут включать в виде нейтральных советов особенности питания больного, его образования, выбора профессии, вида спорта и всю информацию, необходимую для полноценной и здоровой творческой жизни, то есть максимальное применение генеалогической информации для блага больного и его семьи.
Болезни с наследственным предрасположением
Болезни с наследственным предрасположением, по данным экспертов ВОЗ, составляют более 90 % всех болезней человека. К ним относятся распространенные хронические неинфекционные заболевания (например, ишемическая болезнь сердца, сахарный диабет, атеросклероз, гипертоническая болезнь, язвенная болезнь, псориаз, шизофрения, маниакально-депрессивный психоз, онкологические заболевания, бронхиальная астма, умственная отсталость, опухоли, ожирение, остеопороз, эндометриоз). Кроме этих болезней, часто встречаются врожденные пороки развития (например, расщелина губы и/или неба, гидроцефалия, стеноз привратника, анэнцефалия, спинномозговая грыжа, вывих бедра, врожденные пороки сердца). Основу этих заболеваний рассматривают как взаимодействие многих генов (то есть полигенность) с многочисленными внешними факторами. Такие болезни называют многофакторными, или мультифакториальными, или болезними с наследственным предрасположением.
Новый этап в развитии генетики человека начался с 1960-х годов, когда клиницисты показали, что врожденные пороки развития, сахарный диабет, атеросклероз, артериальная гипертензия, некоторые формы рака чаще встречаются в одних семьях, чем в других.
Так, в результате обследования братьев, сестер и родителей больных с расщелиной губы и/или неба было установлено, что у родственников таких больных аналогичная патология встречается в 20 – 40 раз чаще, чем в популяции в целом (в 2 – 4 % случаев среди родственников, в популяции примерно в 0,1 % случаев).
Роль генетических факторов при таких заболеваниях несомненна, и характер семейного накопления может свидетельствовать о влиянии наследственности; однако их нельзя считать такими же наследственными болезнями, как, например, гемофилия или ахондроплазия (в основе которых лежит нарушение работы одного гена и наследование которых подчиняется законам Менделя).
Действительно, наряду с монофакторными признаками (и заболеваниями) существуют более сложные наследственно обусловленные различия между людьми. Они представляют собой непрерывное распределение (например, рост, цвет кожи, косоглазие, атеросклероз, врожденный вывих бедра, уровень артериального давления), поэтому носителя одного из этих генов (или варианта гена – аллеля) невозможно надежно отличить от носителя с другими аллелями этих же генов.
Рассматривая сложные признаки (например, высокое артериальное давление, умственная отсталость, гиперхолестеринемия), можно думать об отклонениях в нормальной генетической системе и полагать наличие возможности случайного неблагоприятного сочетания генов и их вариантов (полигенная система). По-видимому, следует считать, что полигенная основа при мультифакториальных признаках (и заболеваниях) представляет собой не просто группу генов, а способ действия генов и взаимодействия между ними.
Общая характеристика мультифакториальных болезней
В основе любого мультифакториального заболевания лежит не одна, а несколько причин. Причем индивидуальный вклад (эффект) каждой из причин в проявление болезни может быть незначительным, и только суммарный их вклад ведет к развитию заболевания.
При многих мультифакториальных заболеваниях один и тот же патогенетический механизм может быть запущен несколькими способами: либо одной причиной, либо их комбинацией. Предрасположенность – это сумма эффектов многих генетических (главный ген, полигенный комплекс), имеющих основное значение, средовых факторов (соматические аллергены, поведенческие – пристрастие к определенной пище) или социальных влияний (влияние родителей, школы, окружения), обусловливающих для каждого человека большую или меньшую вероятность конкретного заболевания.
Характеризуя генетические причины, необходимо также иметь в виду, что около трети всех структурных генов человека имеют множественные аллели, то есть могут давать полиморфные генные продукты. Понятно, что в таком разнообразии генных вариантов заложена возможность существования людей с неблагоприятным сочетанием наследственных факторов, которые смогут играть определенную роль в развитии того или иного заболевания.
Иными словами, мультифакториальные болезни имеют генетическую (наследственную) и негенетическую (ненаследственную) компоненты и, благодаря первой, в той или иной степени обладают наследственной предрасположенностью. При достижении наследственной компонентой определенного «порога» предрасположенности и действии факторов внешней среды и происходит развитие болезни. Из сказанного следует, что человек даже с необычайно высокой степенью предрасположенности к определенному заболеванию может не заболеть при благоприятных условиях среды, но возможна и обратная картина.
Таким образом, мультифакториальные заболевания являются результатом аддитивного (суммарного, однонаправленного) действия множества генов и большого числа внешних факторов. Относительная роль каждого генетического и средового фактора различна в каждом конкретном случае.
В числе других факторов, повышающих риск предрасположенности к мультифакториальному заболеванию, выделяют: степень родства с больным родственником (пробандом), тяжесть течения болезни, принадлежность больного к редко поражаемому полу (при данном заболевании), число больных лиц в семье пробанда. Примеры, иллюстрирующие зависимость риска мультифакториального заболевания (признака) от числа больных лиц в семье пробанда, приведены в табл. 1.
Таблица 1
Риск мультифакториального заболевания в зависимости от числа больных лиц в семье пробанда
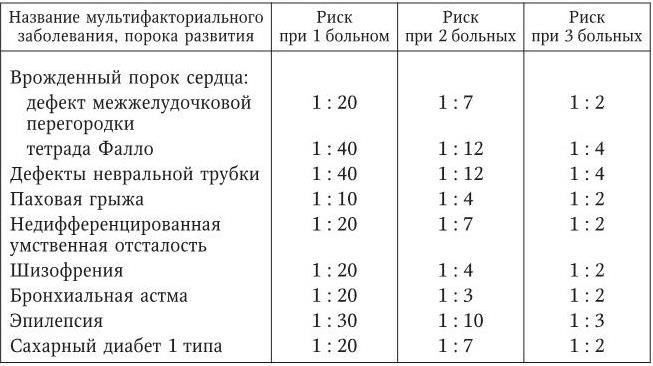
Следует подчеркнуть важность учета семейных негенетических факторов, так как нередко только одним их действием можно объяснить семейный характер заболевания.
Характеристика основных признаков мультифакториальных болезней
Болезни с наследственным предрасположением мультифакториальной природы характеризуются некоторыми особенностями, и для них (при всем их многообразии) можно выделить общие черты:
– частота среди населения выше, чем при монофакторных болезнях (моногенные болезни встречаются с частотой 1 на 5000 – 1 000 000 человек, в то время как, например, шизофренией в течение жизни заболевают около 1 % населения, 5 % – диабетом, 10 % имеют атопии, примерно 30 % – гипертензию);
– семейное накопление не соответствует менделевским типам наследования (аутосомно-доминантному, аутосомно-рецессивному, сцепленному с Х-хромосомой);
– относительно низкая конкордантность по манифестным проявлениям болезни у монозиготных близнецов (60 % и ниже) (табл. 2);
Таблица 2
Конкордантность близнецов при разных типах наследования (Фогель Ф., 1990)
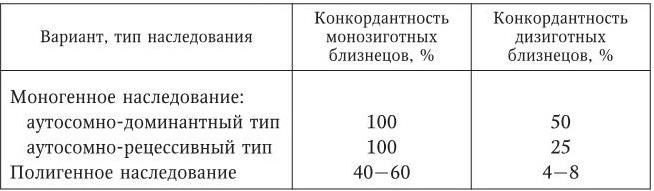
– границу между больными и здоровыми можно провести лишь условно;
– течение болезни может проходить по-разному – от скрытых субклинических проявлений до резко выраженных симптомов (наблюдается существование клинических форм, образующих непрерывный ряд);
– в семье имеет место накопление повторных случаев заболевания в сравнении с частотой болезни в общей популяции;
– проявление заболевания зависит от возраста, пола, беременности, эндокринных влияний и питания;
– частота заболевания среди сибсов пробандов существенно выше, если поражен один из родителей, чем при здоровых родителях.
Факторы, затрудняющие диагностику болезней с наследственным предрасположением
Клиническая картина мультифакториальных заболеваний характеризуется большим разнообразием в проявлении симптомов и тяжести течения по сравнению с моногенными.
Природа их неоднозначна, поэтому они принципиально неоднородны как в количественном (тяжесть течения), так и в качественном (симптомы болезни) отношениях. Иначе говоря, размах и тяжесть проявления заболевания плавно переходят в пограничные состояния, редуцированные формы, в «нормальные границы» (границу между нормой и патологией провести трудно, так как она стерта, размыта). Проявление патологического признака в семье может меняться от практического здоровья до тяжелейших форм течения с проявлением заболевания в раннем возрасте.
Все сказанное, а также часто встречающиеся пограничные состояния при мультифакториальных заболеваниях затрудняют диагностику.
Сравнение моногенных и мультифакториальных заболеваний
Некоторые характерные особенности моногенных и мультифакториальных болезней представлены в табл. 3.
Таблица 3
Основные дифференциально-диагностические различия моногенных и мультифакториальных болезней


Соотношение факторов наследственности и среды
В основе любого мультифакториального заболевания лежит не одна, а несколько причин. Причем индивидуальный вклад каждой из причин в проявление болезни может быть незначительным, и только суммарный их эффект ведет к развитию заболевания. Таким образом, к мультифакториальным признакам (заболеваниям) относятся признаки, обусловленные многими генетическими и внешними факторами, взаимодействующими друг с другом суммарным образом, причем имеется различная генетическая предрасположенность к таким заболеваниям у разных лиц.
В последние 20 лет генетика человека все больше ориентирована на выявление роли генетических факторов в этиологии широко распространенных заболеваний. Одновременно выявляется значение факторов среды, и в частности семейной обстановки, которая сама по себе может объяснить некоторые закономерности распределения болезней в семьях. Таким образом, основным направлением в генетике человека в настоящее время становится идея перехода к систематическому изучению взаимодействия между генотипом и средой.
Главные гены
Некоторые исследователи считают, что возникновение мультифакториального заболевания зависит от наследственного предрасположения, обусловленного главным геном, полигенным компонентом и факторами среды. (Следует обратить внимание, что факторы среды могут быть либо случайными, либо, напротив, общими для членов одной семьи – например, традиции, пищевые привычки – потребление сахара как фактор риска диабета, соли как фактор риска гипертонической болезни.) В настоящее время все больше исследователей приходят к заключению, что на фоне совместного и однонаправленного действия нескольких мутантных генов болезнь может возникнуть и в результате влияния одного главного гена.
В патогенез каждого заболевания, в том числе и мультифакториального, вовлекается много разных функционально взаимосвязанных генов (генные сети), включающих, наряду с главными генами, ответственными за начало болезни, другие, второстепенные гены, так называемые гены-модификаторы, эффект которых во многом и определяется внешними факторами.
Следует отметить, что между заболеваниями, обусловленными мутацией одного известного гена, контролирующего определенный белок, и болезнями, для которых можно установить лишь генетическое предрасположение, существует принципиальная разница. В первом случае вполне возможно генетическое консультирование: можно установить вероятность возникновения определенного заболевания в потомстве того или иного индивидуума. Во втором случае картина совершенно иная: целью генетического анализа является обнаружение генетических факторов, и в частности главных генов, обусловливающих предрасположение определенных лиц к тем или иным заболеваниям.
В последние годы изучение роли наследственных факторов в природе мультифакториальных заболеваний характеризуется выраженным клинико-генетическим подходом. Основные усилия направлены на выявление генетической гетерогенности мультифакториальных болезней, то есть установление разной генетической природы фенотипически однородных заболеваний.
Анализ генетической гетерогенности состоит в установлении и идентификации моногенных форм (выделение главного гена). Часто возникает необходимость обосновать с помощью соответствующих клинических, лабораторных и генетических методов выделение в пределах мультифакториальных заболеваний редких вариантов самостоятельных форм патологии с четким менделевским наследованием.
Действительно, почти всегда в рамках мультифакториального заболевания можно идентифицировать редкие менделевские синдромы. Так, например, Х-сцепленная недостаточность фермента гипоксантин-гуанин-фосфорибозилтрансферазы составляет 1 % всех случаев подагры. Некоторые случаи гипертонической болезни вызываются редкой наследственной феохромоцитомой. Язвенная болезнь желудка и двенадцатиперстной кишки выступает как часть симптомокомплекса при болезни Золлингера – Эллисона. Рак пищевода возникает при генетически обусловленных кератомах одновременно на ладонях и подошвах. Около 5 % лиц с ранним инфарктом миокарда оказываются гетерозиготными по семейной гиперхолестеринемии (моногенному нарушению, вызывающему атеросклероз, даже при отсутствии какого-либо другого фактора предрасположенности), что является следствием дефекта рецепторов липопротеидов низкой плотности. В связи со сказанным необходимо помнить, что среди фенотипов распространенных заболеваний некоторая доля будет определяться главными мутантными генами.
Кроме того, мультифакториальные заболевания неоднородны в том смысле, что сравнительный вклад в этиологию полигенных факторов («генов риска») и факторов окружающей среды сильно варьируется у разных индивидов. Существующие представления о патогенезе позволяют предполагать, что клинически идентично протекающие заболевания могут представлять собой совокупность синдромов, общих для многих разных причин.
Фактически становится очевидным, что такие диагнозы, как атеросклероз, гипертензия или диабет, объединяют неоднородные (гетерогенные) группы самостоятельных клинико-генетических вариантов и форм патологии.
Исследование семейного распределения значений какого-либо количественного показателя (например, уровня холестерина или мочевой кислоты в крови, внутриглазного давления при изучении глаукомы), интенсивно разрабатываемое в последнее время, позволяет более тонко изучить влияние различных факторов и делает возможным выявление главного гена. Таким образом можно вскрыть одновременное влияние нескольких наследственных факторов на исследуемый признак. Так, по крайней мере, два гена (BRCA1, BRCA2) могут определять развитие рака молочной железы, три гена (PS1, PS2, ААР) – развитие болезни Альцгеймера, считается, что более четырех генов участвуют в формировании атеросклероза, диабета, шизофрении, маниакально-депрессивного психоза. Однако для проявления таких болезней необходимо воздействие различных неблагоприятных влияний внешней среды.
Таким образом, механизм развития многих мультифакториальных заболеваний может быть осуществлен несколькими способами: либо одной причиной, либо комбинацией нескольких причин. Во-первых, среди основных причин следует выделить генетические – главный ген и полигенные комплексы; во-вторых, может иметь место сочетание внешних воздействий и различных соматических антигенов; в-третьих, основная роль принадлежит поведенческим привычкам, пристрастиям к определенной пище или социальным факторам (влияние родителей, школы, окружения).
Понятно, что только проведение своевременной профилактики до клинических проявлений болезни и ранней диагностики первых симптомов различных заболеваний – наиболее эффективный способ сохранения здоровья человека. Профилактика предполагает целенаправленную, в частности фармакологическую коррекцию фенотипа, которая должна иметь фармакогенетическое обоснование. Это и является наиболее актуальными проблемами современной медицины.
Медико-генетический подход основан на семейно-клинических исследованиях и концепции генетического риска.
Профилактика заболеваний – основная цель генетики человека. Изучение роли генетических факторов в развитии заболеваний очень важно для понимания природы последних; при этом образование врача в области генетики человека и медицинской генетики приобретает чрезвычайное значение.
Когда речь идет о профилактической медицине, в связи со сказанным становится понятна значимость и необходимость медико-генетического консультирования, выявления групп повышенного генетического риска конкретного заболевания на основании анализа семейных данных и создания для них оптимальных условий среды с исключением патогенетических факторов (факторов риска), способных предотвратить или отодвинуть проявление болезни. Особенно актуален такой подход в отношении болезней, проявляющихся в зрелом возрасте, развитие которых зависит от генетической предрасположенности в сочетании с неблагоприятными внешними факторами (лекарства, продукты питания, вредные привычки, загрязнение окружающей среды, инфекции). Выявление лиц группы высокого риска до появления признаков заболевания имеет принципиальное значение для правильного медико-генетического консультирования с последующим проведением своевременных, адекватных и целенаправленных мер профилактики (в том числе и генетическое образование врачей).






