Нейрогуморальная регуляция репродуктивной системы
Репродукция, или воспроизводство, является важнейшей функцией женского организма. Репродуктивная система представлена внерепродуктивными органами (структуры ЦНС: аркуатные ядра гипоталамуса, гонадотрофы гипофиза) и репродуктивными органами (яичники и органы–мишени: матка, маточные трубы, влагалище). Эти структурные элементы системы связаны между собой информационными сигналами, позволяющими ей функционировать как единое целое. Система начинает активно функционировать в период половой зрелости, или репродуктивный период, который длится с 16–17 лет до 45 лет. В репродуктивной системе выделяют 5 уровней: I уровень – ткани–мишени, II – яичники, III – аденогипофиз, IV – гипоталамус и V –экстрагипоталамические церебральные структуры и кора головного мозга (рис. 5.1). Первый уровень репродуктивной системы – ткани–мишени – точки приложения действия половых стероидных гормонов. К ним относятся половые органы, молочные железы, волосяные фолликулы, кожа, кости, жировая ткань. Свободная молекула стероидного гормона проникает через клеточную мембрану, затем в ядро клетки и соединяется с белковым рецептором. Далее происходит взаимодействие комплекса гормон–рецептор с ядерной ДНК, синтез мРНК, транспорт мРНК в рибосомы и синтез специфического белка в цитоплазме клетки (рис. 5.2). Рецепторы обладают специфичностью к эстрадиолу, прогестерону, тестостерону. При действии стероидных гормонов на клетки–мишени происходит снижение числа рецепторов. Уменьшение содержания рецепторов стимулирует их новый синтез. Стероиды регулируют не только концентрацию своих собственных рецепторов: эстрогены стимулируют рецепторы прогестерона, а прогестерон, как правило, понижает концентрацию рецепторов эстрогенов в репродуктивном тракте.
Основной тканью–мишенью для половых стероидов является эндометрий. Содержание рецепторов эстрогенов и прогестерона в нем изменяется в зависимости от фазы цикла. Концентрация рецепторов эстрадиола (Е2) достигает пика в предовуляторном периоде и соответствует выбросу Е2 в периферический кровоток, что ведет к усилению клеточного деления и увеличению массы эндометрия. Одновременно под влиянием Е2 возрастает концентрация рецепторов прогестерона. После овуляции происходит снижение уровня Е2–рецепторов в цитоплазме в ответ на повышение концентрации прогестерона. В лютеиновую фазу прогестерон, концентрация которого увеличивается, тормозит синтез своих собственных рецепторов.
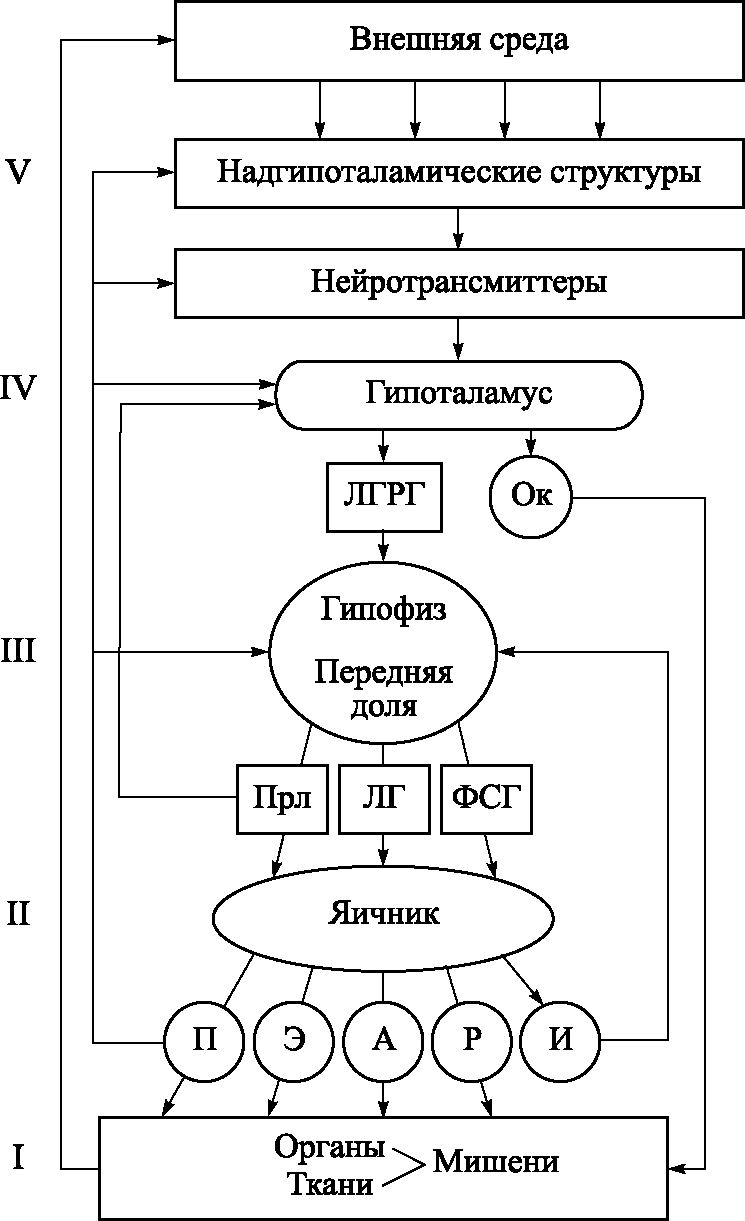
Рис. 5.1. Уровни регуляции (I–V) репродуктивной системы. Нейтротрансмиттеры (дофамин, норадреналин, серотонин; опиоидные пептиды; ?–эндорфины, энкефалин); Ок – окситоцин; П – прогестерон; Э – эстрогены; А – андрогены; Р – релаксин; И – ингбин
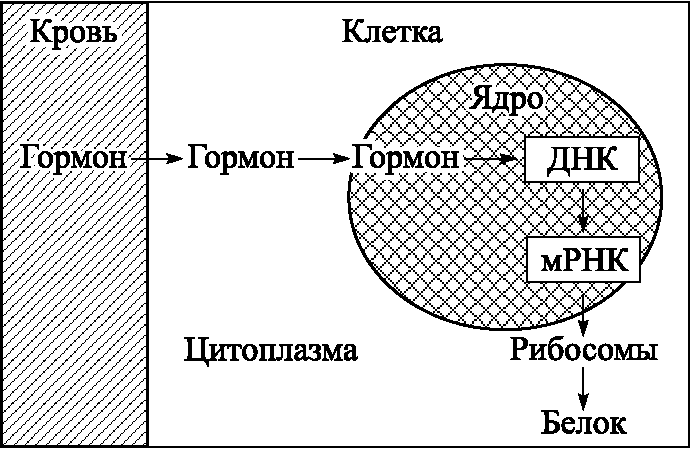
Рис. 5.2. Механизм взаимодействия стероидного гормона и клетки–мишени
Рецепторы половых стероидных гормонов имеются в ЦНС. Они локализуются в перивентрикулярной области гипоталамуса, включая аркуатное ядро, и в передней доле гипофиза. Взаимодействуя с этими рецепторами, эстрадиол оказывает модулирующее действие на секрецию гонадолиберина и гонадотропных гормонов, осуществляя обратную связь.
Второй уровень репродуктивной системы – яичники. Здесь происходят процессы фолликулогенеза и синтеза стероидных гормонов.
Основная морфофункциональная единица яичника – фолликулярный комплекс. Ключевым элементом комплекса является овоцит. Предшественники овоцитов – овогонии, возникают из примордиальных герминативных клеток. Между 8–й и 13–й неделями внутриутробного развития овогонии превращаются в первичные овоциты.
У плода первичный овоцит окружен одним слоем веретенообразных клеток, являющихся предшественниками гранулезных. Они отделены от окружающей стромы базальной мембраной. Этот комплекс овоцита, окруженного клетками и базальной мембраной, называется примордиальным фолликулом (рис. 5.3). На 5–6–м месяце беременности веретенообразные клетки превращаются в кубовидные, которые начинают делиться и превращаются в гранулезные. Гранулезные клетки продуцируют мукополисахариды, окружающие овоцит прозрачной оболочкой (zona pellucida). Через нее проникают отростки гранулезных клеток к плазматической мембране овоцита, обеспечивая его информацией и питательными веществами (первичный фолликул). Когда слой фолликулярного эпителия, окружающего овоцит, утолщается до 8–10 рядов клеток, формируется вторичный (преантральный) фолликул. Веретенообразные клетки стромы, окружающие фолликул, превращаются в тека–клетки.
Когда размер первичного фолликула достигает 100–200 мкм, среди гранулезных клеток появляются скопления жидкости и образуется третичный фолликул. Постепенно скопления жидкости сливаются и образуют полость фолликула (antrum), после формирования которой фолликул превращается в зрелый (полостной, или граафов фолликул). В полостном (антральном) фолликуле происходит дальнейшее нарастание числа рядов фолликулярного эпителия, образующего гранулезную оболочку. Текальная оболочка делится на наружную и внутреннюю. Овоцит, окруженный 2–3 слоями гранулезных клеток в виде лучистого венца, отодвигается к периферии фолликула, образуя яйценосный бугорок. Клетки бугорка контактируют с гранулезными клетками, окружающими полость фолликула.
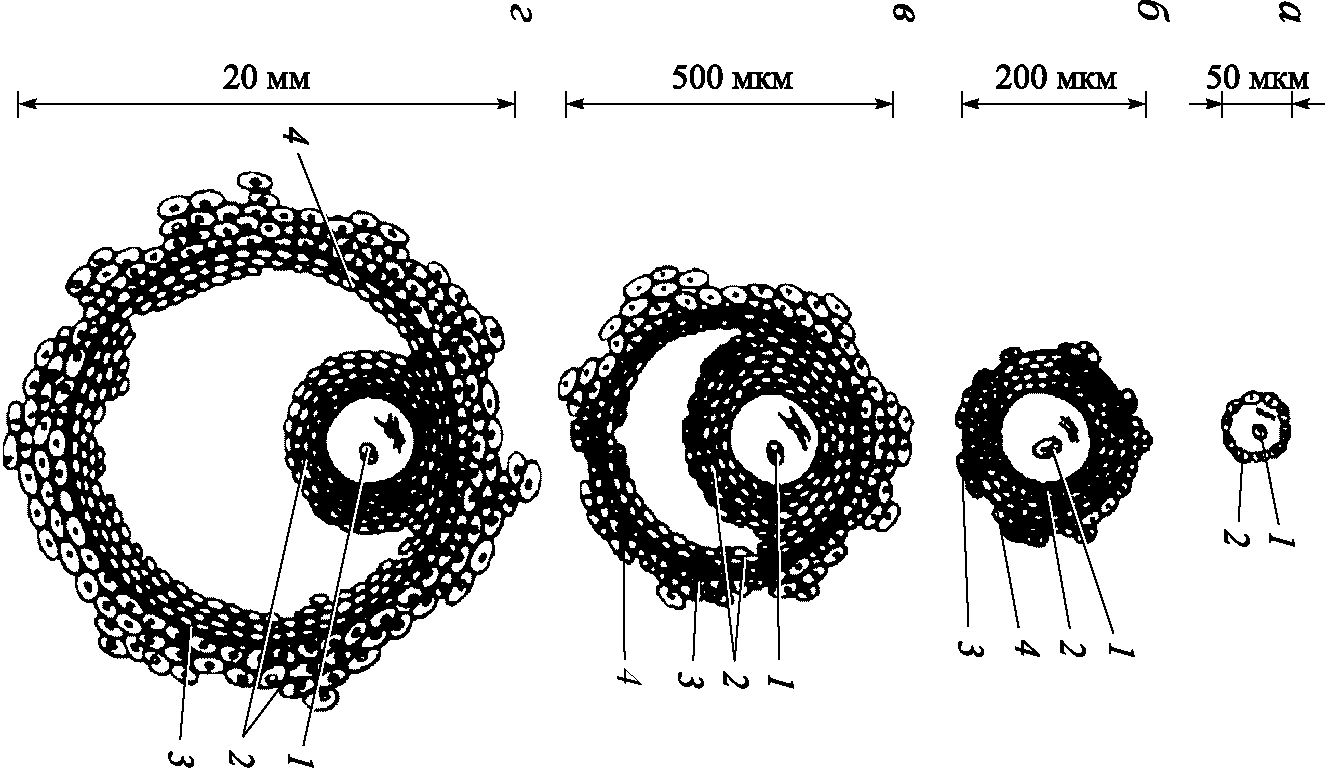
Рис. 5.3
Рост неактивных примордиальных фолликулов до ранней предполостной стадии не зависит от действия гонадотропинов, но дальнейший их рост и развитие контролируются ФСГ и ЛГ. До менархе не происходит полного созревания фолликулов: не достигнув предовуляторной стадии, они подвергаются атрезии. Если при рождении девочки в яичниках имеется 2–4 млн примордиальных фолликулов, то к менархе остается около 200– 400 тысяч, а за весь репродуктивный период женщины овулирует только 400–500 фолликулов. С наступлением менархе в яичниках начинаются циклические изменения (яичниковый цикл).
Фолликулогенез (развитие фолликулов) условно включает рост и дифференцировку примордиальных фолликулов до преантральных (около 120 дней), базальный рост преантральных фолликулов до стадии малых антральных диаметром 1–2 мм (около 65 дней), выбор когорты (группы) малых антральных фолликулов, их рост, селекцию и созревание доминантного фолликула (около 20 дней). Таким образом, фолликулогенез не ограничивается одним яичниковым циклом и в среднем занимает от 85 до 200 дней.
Яичниковый цикл состоит из трех фаз: фолликулярной, овуляции и лютеиновой.
В фолликулярную фазу рост фолликулов и синтез в них гормонов происходят при координированном действии гонадотропинов и местных яичниковых факторов (рис. 5.4). На фоне регресса желтого тела, примерно за 1 день до менструации, в ответ на спад гормонов повышается уровень ФСГ. Это является стимулом для рекрутирования группы растущих фолликулов. В раннюю фолликулярную фазу (1–4–й день цикла) ФСГ стимулирует рост группы малых антральных фолликулов, повышает активность ароматаз в гранулезных клетках, что ведет к увеличению продукции эстрогенов и ингибина. Эстрогены повышают чувствительность клеток гранулезы к ФСГ. К середине фолликулярной фазы (5–7–й дни) из группы растущих фолликулов происходит отбор доминантного фолликула, предназначенного к овуляции. Доминантным становится фолликул наибольшего диаметра, с наибольшим числом клеток гранулезы и рецепторов ФСГ.
В позднюю фолликулярную фазу (8–12–й дни) подъем уровня эстрогенов, образующихся в доминантном фолликуле, приводит к подавлению секреции ФСГ по механизму обратной связи. Это ведет к торможению роста и атрезии остальных фолликулов. Механизм атрезии, по–видимому, связан с апоптозом.
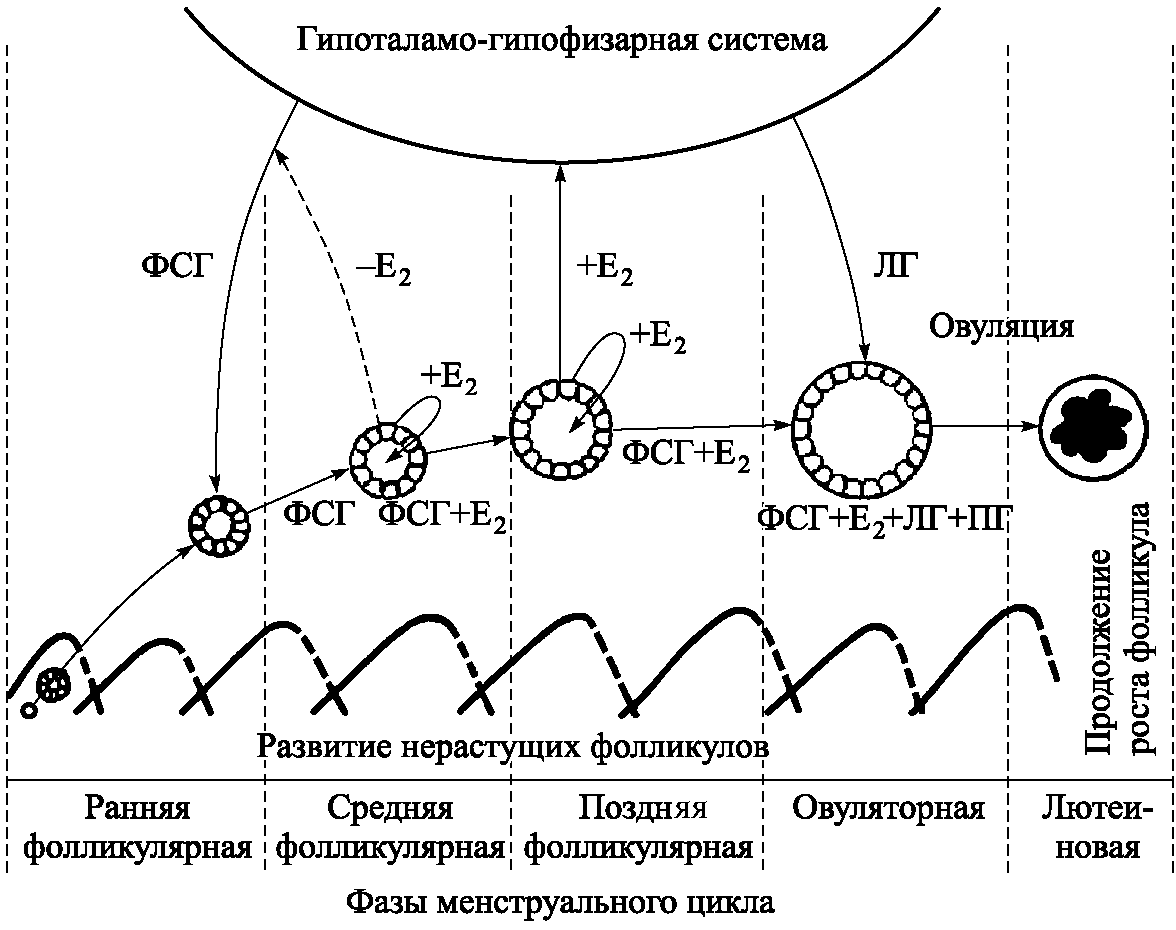
Рис. 5.4. Развитие овулирующего (доминантного) фолликула
Рост доминантного фолликула и способность его синтезировать эстрогены в условиях снижения уровня ФСГ сохраняются благодаря переходу с ФСГ–зависимого на ЛГ– и ФСГ–зависимый рост и включению местных яичниковых регуляторных механизмов: аутокринного (стимуляция эстрогенами синтеза собственных рецепторов) и паракринного (увеличение количества гранулезных клеток и, тем самым, числа рецепторов ФСГ вследствие прямого митогенного действия эстрогенов). Таким образом, ФСГ и эстрогены, действуя синергично, стимулируют рост доминантного фолликула.
В доминантном фолликуле к 9–му дню цикла резко увеличивается васкуляризация тека–клеток. Это обеспечивает усиленное поступление в доминантный фолликул гонадотропинов и липопротеинов низкой плотности (ЛПНП), необходимых для синтеза половых стероидов. Кроме того, в предовуляторный период ФСГ и эстрогены стимулируют образование рецепторов ЛГ в гранулезных клетках. С этого момента начинается процесс их лютеинизации и переключение стероидогенеза с эстрогенов на прогестины. Эти процессы происходят в предовуляторном фолликуле непосредственно до и в течение всего периода (48 ч) овуляторного выброса гонадотропинов. Овуляторный пик секреции ЛГ и ФСГ по времени связан с пиком секреции эстрогенов и быстрым увеличением уровня прогестерона.
Когда диаметр предовуляторного фолликула достигает 20– 21 мм, в фолликулярной жидкости, объем которой увеличивается в 100 раз, нарастает осмотическое давление за счет деполимеризации полисахаридов. Клетки в области лучистого венца разрыхляются, увеличиваются межклеточные пространства. На вершине предовуляторного фолликула формируется небольшая бессосудистая зона–стигма. Стенка в этой зоне представлена одним рядом клеток гранулезы, которые прилежат непосредственно к поверхностному эпителию яичника. Здесь происходит разрыв фолликула во время овуляции. В предовуляторном фолликуле возобновляется мейоз, необходимый для созревания овоцита.
Под влиянием окситоцина, простагландинов, стимуляции ?–адренорецепторов и холинергических рецепторов, а также коллагеназы и плазмина увеличивается растяжимость оболочки яичника. Вслед за разрывом стигмы происходит овуляция – выход овоцита вместе с клетками яйценосного бугорка и фолликулярной жидкостью в брюшную полость. Овуляция происходит через 12 ч после пика ЛГ или через 24–36 ч после пика эстрадиола (Е2). После овуляции на месте фолликула образуется желтое тело, которое в своем развитии проходит стадии пролиферации, васкуляризации, расцвета и регресса. На стадии пролиферации продолжается размножение и лютеинизация клеток гранулезы, происходит лютеинизация клеток внутренней теки. На стадии васкуляризации в гранулезолютеиновую ткань врастают тонкостенные кровеносные сосуды из внутренней теки и продвигаются в направлении центральной полости желтого тела, обычно содержащей сгусток крови (центральное ядро желтого тела). Клетки гранулезы становятся крупными, полигональными. На стадии расцвета желтое тело окончательно сформировано, достигает величины 1–1,5 см; клетки его богаты цитоплазмой, содержащей капельки липидов и липохромный пигмент. Наибольшая активность желтого тела приходится на 7–8–й день после пика секреции ЛГ. В нем происходит максимальная секреция прогестерона и, в меньшей степени, эстрогенов. Параллельно нарастанию уровня половых стероидов в крови снижается содержание ЛГ и ФСГ. Желтое тело доминирует в лютеиновую фазу цикла, подавляя рост других фолликулов в обоих яичниках. Период его существования постоянен и составляет 10–12 дней. Регресс желтого тела (лютеолиз) начинается за 2–3 дня до наступления менструации и обусловлен дистрофическими процессами в лютеиновых клетках. Лютеолиз, по–видимому, связан с действием ПГФ2а, окситоцина и вазопрессина. Лютеолиз сопровождается быстрым падением уровней прогестерона и эстрогенов.
Устранение механизма обратной связи со стороны половых стероидов вызывает реактивацию гипоталамо–гипофизарной системы, что дает начало отбору новой когорты фолликулов, которые продолжат развитие в следующем цикле.
Секреторная функция яичников заключается в синтезе половых стероидных гормонов: эстрогенов, андрогенов, прогестерона. Стероидпродуцирующими тканями яичников являются клетки гранулезы, выстилающие полость фолликула, клетки внутренней теки и строма.
В синтезе эстрогенов синергично участвуют клетки гранулезы и теки, имеющие на своей поверхности рецепторы ФСГ и ЛГ (рис. 5.5). Клетки внутренней теки и в значительно меньшей степени строма являются источниками андрогенов. Прогестерон синтезируется в тека–клетках и клетках гранулезы фолликула. В желтом теле прогестерон продуцируют гранулезолютеиновые клетки, а эстрогены – тека–лютеиновые.
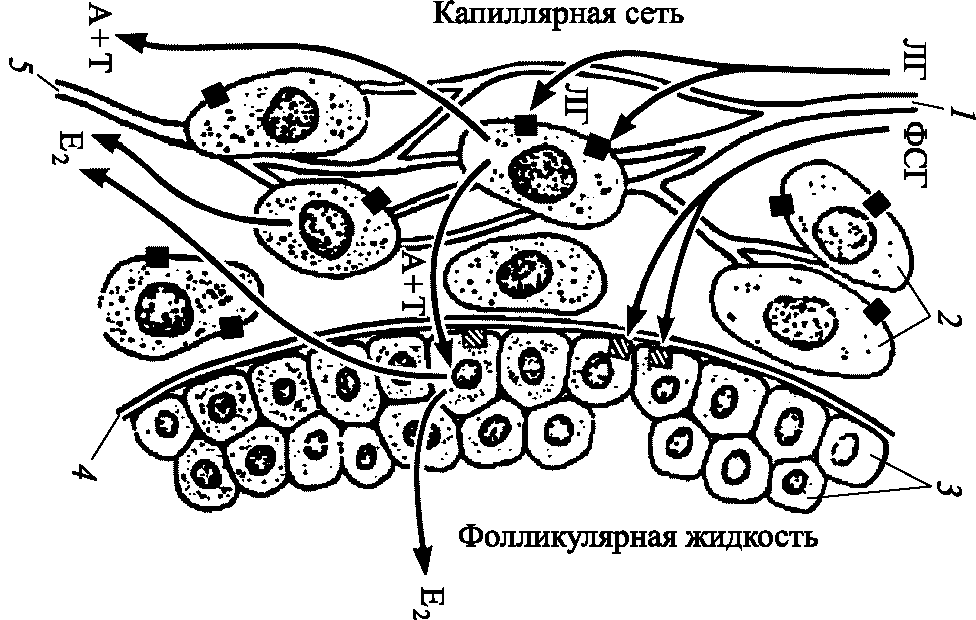
Рис. 5.5.
Источником синтеза всех стероидных гормонов является холестерин, поступающий в яичник в составе ЛПНП с током крови. В тека–клетках под влиянием ЛГ из него синтезируются прегненолон и андрогены – андростендион и тестостерон, которые затем попадают в фолликулярную жидкость и гранулезные клетки, где ароматизируются в эстрогены – эстрадиол и эстрон (рис. 5.6). Активность ароматазы (фермент цитохром Р450) и ароматизация андрогенов в эстрогены контролируется ФСГ.
Основными классическими фракциями эстрогенов являются эстрон (Е1), 17р–эстрадиол (Е2) и эстриол (Е3). Наиболее активным эстрогеном является Е2: 95% его от общего пула стероидов синтезируется доминантным фолликулом. Около 10% Е2 ароматизируется из тестостерона вне яичника. В раннюю фолликулярную фазу секретируется 60–100 мкг Е2, к моменту овуляции – 400–900 мкг, в лютеиновую фазу – 270 мкг в сутки. Только половина образующегося Е1 секретируется яичником, вторая его половина ароматизируется в Е2. Кроме того, Е1 может образовываться из андростендиона путем ароматизации вне яичника, Е3 в отсутствие беременности рассматривают как метаболит Е1 и Е2.
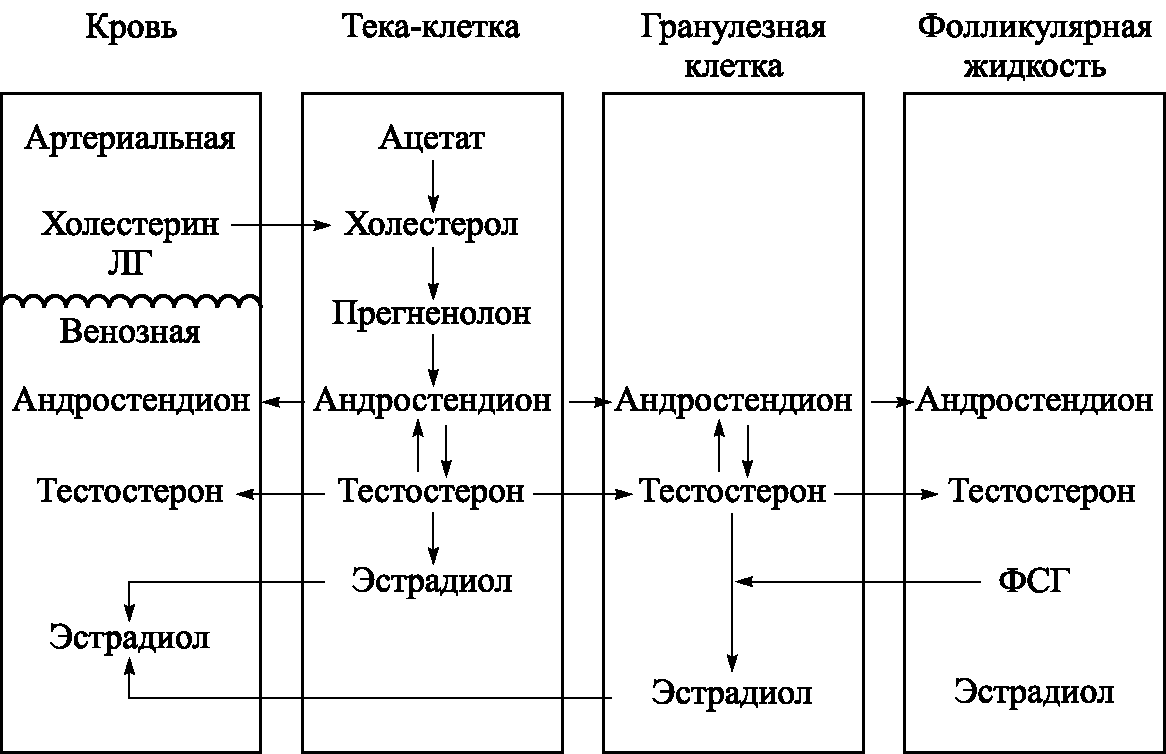
Рис. 5.6.
В фолликулярную фазу в яичнике образуется около 2 мг/сут прогестерона, в предовуляторный период – 4 мг/сут и в лютеиновую фазу – 25 мг/сут.
Андрогены представлены в яичнике, главным образом, андростендионом и тестостероном. В яичнике образуется около 1,5 мг/сут андростендиона, из него образуется 0,15 мг тестостерона. Около 15% тестостерона ароматизируется в дегидротестостерон (75 мкг/сут), который является наиболее активным внутриклеточным андрогеном сальных желез и волосяных фолликулов у женщин. Предшественники тестостерона – дегидроэпиандростерон (ДЭА) и дегидроэпиандростерон–сульфат (ДЭА–С) образуются преимущественно в коре надпочечников.
Основная масса стероидных гормонов (80%) находится в крови и транспортируется в связанном состоянии со специфическими белками – стероидсвязывающими глобулинами и неспецифическими транспортными системами – альбумином, эритроцитами. Связанные стероиды биологически неактивны. Эстрадиол и тестостерон соединяются с ?–глобулином, связывающим половые стероидные гормоны. Он синтезируется в печени под контролем Е2, тестостерона и инсулина. Его сродство к Е2 в 5 раз ниже, чем к тестостерону, и еще ниже к прогестерону. Известно два прогестеронсвязывающих глобулина. Около 10% стероидов связывается с альбумином. Сродство стероидов к альбумину снижается на фоне приема нестероидных противовоспалительных препаратов. Почти 20% стероидных гормонов связывается с эритроцитами, причем они могут взаимодействовать как с мембраной, так и с участками, находящимися внутри эритроцита. Метаболизм половых стероидных гормонов происходит в печени. Обмен эстрогенов протекает по схеме: эстрадиол – эстрон – эстриол – нестероидные продукты. Все три фракции эстрогенов с помощью печеночных ферментов присоединяют глюкуроновую или сульфатную группу и становятся водорастворимыми. Образовавшиеся глюкурониды и сульфаты поступают в желчь, а с ней в кишечник. В нем часть эстрогенов реабсорбируется, а часть выделяется с калом. Основное количество эстрогенов (около 50–70%) выделяется с мочой. Главный метаболит прогестерона – прегнандиол, после соединения с глюкуроновой кислотой выделяется из организма с мочой. Продуктами обмена андрогенов являются 17–кетостероиды (17–КС). Фракции 17–КС яичникового происхождения представлены андростероном, эпиандростероном и этиохоланолоном. Основная их часть (65–70%) выделяется с мочой.
Кроме основных стероидных гормонов в гранулезных клетках фолликулов образуется белковый гормон ингибин, тормозящий выделение ФСГ гипофизом. Из венозной крови яичников женщин выделен фолликулярный протеин, ингибирующий ароматазу. Он предупреждает увеличение яичников в ответ на стимуляцию гонадотропинами. Количество его увеличивается по мере роста фолликула. В фолликулярной жидкости обнаружен ингибитор созревания овоцита, который, по–видимому, синтезируется гранулезными клетками яйценосного холмика. Его действию на овоцит препятствует ЛГ. Имеются данные о присутствии в малый фолликулах ингибитора, а в больших – стимулятора лютеинизации гранулезных и тека–клеток. В фолликулярной жидкости, желтом теле, матке и маточных трубах обнаружен окситоцин. В яичнике он оказывает лютеолитическое действие, способствуя регрессу желтого тела, блокирует секрецию прогестерона, вызывает высвобождение ПГФ2а. Важная роль в стимуляции синтеза простагландинов в предовуляторном фолликуле принадлежит ЛГ. ПГФ2а вместе с окситоцином участвует в овуляции путем усиления сократительной активности контрактильных элементов внутренней теки и в регрессе желтого тела. В желтом теле в небольших количествах образуется релаксин. Концентрация его велика в желтом теле при беременности. Релаксин способствует овуляции и оказывает токолитическое действие на миометрий, вызывает релаксацию связочного аппарата межлобкового сочленения. В желтом теле из прогестерона под влиянием фермента 21–гидроксилазы почечного происхождения может образовываться дезоксикортикостерон. Этот сильный минералокортикоид может играть значительную роль в регуляции водно–минерального баланса и сосудистого тонуса во время лютеиновой фазы цикла.
Получены данные, что на процесс фолликулогенеза и синтеза стероидных гормонов влияют некоторые факторы роста: инсулиноподобные факторы роста–1 и 2 (ИПФР–1 и ИПФР–2), эпидермальный фактор роста (ЭФР), трансформирующие факторы роста–а и –Р (ТФР–а и –Р), сосудистый эндотелиальный фактор роста (СЭФР). ИПФР синтезируются в печени и в гранулезных клетках растущего фолликула под влиянием соматотропного гормона (СТГ). ИПФР–1 участвует в синтезе эстрадиола, но под влиянием инсулина ИПФР–1 может усиливать синтез андрогенов в тека–клетках и интерстициальной ткани яичника. ЭФР активно влияет на клеточную пролиферацию, способен тормозить синтез стероидов в яичнике. ТФР–а и –Р оказывают непосредственное влияние на процессы, происходящие в гранулезных клетках, связанные с ростом и созреванием фолликулов. СЭФР усиливает проницаемость сосудов, обладает мощным митогенным эффектом и обеспечивает функциональную активность гранулезных клеток предовуляторного фолликула. Протеины с активностью факторов роста модулируют как амплитуду, так и скорость ответа фолликула на действие ЛГ и ФСГ. Изучается роль цитокинов (интерлейкинов –1 и –6) в стероидогенезе, пролиферации и лютеинизации гранулезных клеток, неоваскуляризации развивающихся фолликулов. Они действуют пара– и аутокринно, влияя на внутрияичниковые процессы.
Третий уровень регуляции представлен передней долей гипофиза – аденогипофизом, секретирующим гонадотропные гормоны (ГТ): фолликулостимулирующий гормон (ФСГ, или фоллитропин), лютеинизирующий гормон (ЛГ, или лютропин) и пролактин (ПРЛ). ФСГ и ЛГ являются гликопротеинами и секретируются базофильными клетками – гонадотрофами. Гонадотрофы человека гетерогенны: одни содержат ЛГ, другие – ФСГ, третьи – оба ГТ.
Пролактин является полипептидом и секретируется ацидофильными клетками – лактотрофами. По химическому строению и биологическим свойствам ПРЛ наиболее близок к СТГ и плацентарному лактогену. Основную роль в регуляции репродуктивной функции отводят низкомолекулярной форме ПРЛ.
Секреция ГТ контролируется ЦНС посредством гипоталамических нейропептидов и трансмиттеров, поступающих по портальной системе в переднюю долю гипофиза, и механизмом обратной связи со стороны стероидных гормонов и ингибина яичников. В ответ на каждый импульс выброса ГТ гипоталамусом идет пульсирующий выброс ФСГ и ЛГ. Частота и амплитуда импульсов ГТ изменяется в соответствии с фазой менструального цикла. В фолликулярную фазу пульсация ЛГ высокочастотная (периодичность импульсов – 60–120 мин) и низкоамплитудная. Она сохраняется на таком уровне до предовуляторного периода, когда выброс ЛГ становится высокоамплитудным. После овуляции и образования желтого тела частота импульсов ЛГ снижается до 4–часовых и более интервалов, а их амплитуда увеличивается в 2 раза по сравнению с ранней фолликулярной фазой. Пульсация ФСГ менее выражена, чем ЛГ.
Циклическое выделение гонадотропинов в репродуктивном периоде жизни женщины определяется действием гормонов яичника на гипофиз и/или гипоталамус (рис. 5.7). По мере увеличения секреции Е2 доминантным фолликулом усиливается торможение секреторной функции аденогипофиза по механизму отрицательной обратной связи. При достижении критического уровня Е2 (около 300 нг/мл) проявляется его кратковременный стимулирующий эффект на секрецию ГТ, обусловливающий пиковый выброс ЛГ и в меньшей степени ФСГ по механизму положительной обратной связи и последующую овуляцию. После образования желтого тела проявляется совместный угнетающий эффект Е2 и прогестерона на секрецию ГТ. По мере снижения секреторной функции желтого тела в поздней лютеиновой фазе возобновляется высокочастотная импульсная секреция ГТ и уровень их постепенно возрастает вплоть до наступления следующего цикла.
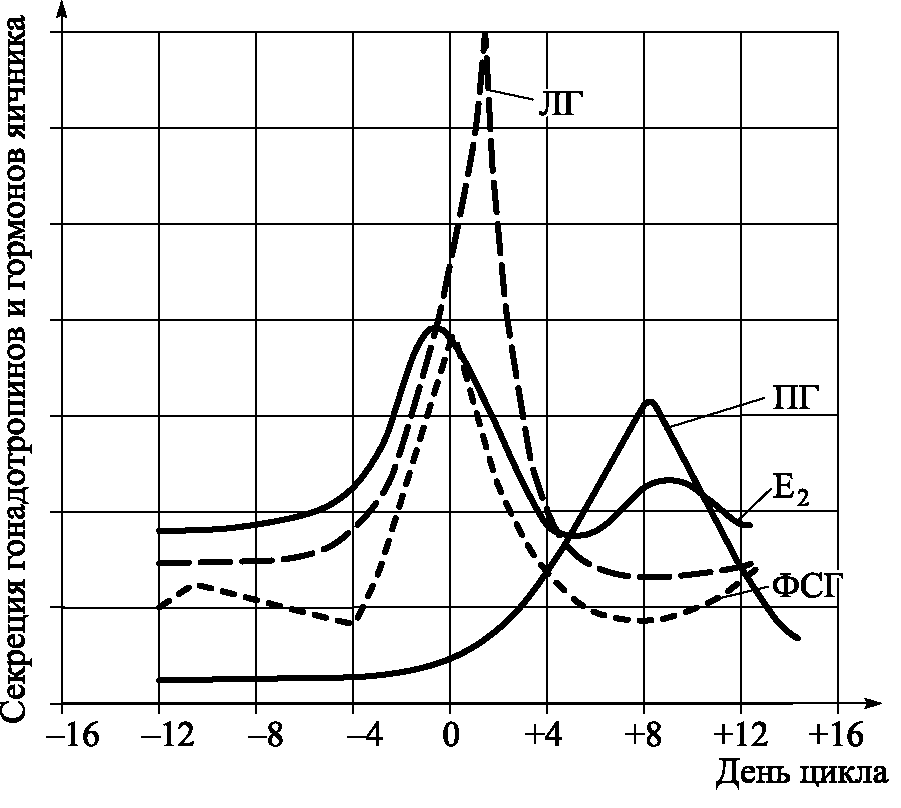
Рис. 5.7.
Местом приложения тормозящего обратного эффекта Е2 является аденогипофиз, а прогестерона – аркуатные ядра гипоталамуса. Малые количества прогестерона (предовуляторная секреция) стимулируют высвобождение гонадотропинов на уровне гипофиза (механизм положительной обратной связи). Е2 снижает амплитуду импульсов ГТ, а прогестерон – их частоту.
Ритм секреции ПРЛ также меняется в течение менструального цикла. Его уровень имеет тенденцию к увеличению в середине цикла и в лютеиновой фазе. Это связано с возрастанием не частоты, а амплитуды импульсов. Механизмы, индуцирующие пульсирующую секрецию ПРЛ, пока неясны. Они исходят не из гипоталамуса, а из гипофиза.
Между гонадотрофами и пролактотрофами имеются межклеточные связи. Поэтому возможен вариант обратного влияния, т.е. изменение активности гонадотрофов при изменении секреции ПРЛ (например, снижение секреции ГТ при гиперпролактинемии).
Основными регуляторами секреции ПРЛ являются пролактолиберин и пролактостатин.
Синтез и секреция ПРЛ возможны в эндометрии, плаценте, эпителиальных клетках тонкой кишки, раковых клетках легких и почек.
Органами–мишенями для ГТ являются яичники. Рецепторы ФСГ и ЛГ локализуются на клеточной мембране. После связывания гормона с мембранным рецептором в клетке–мишени происходит активация аденилатциклазы (1–й посредник), что приводит к образованию из АТФ цАМФ (внутриклеточный переносчик сигнала – 2–й посредник), а цАМФ активирует протеинкиназу, катализирующую фосфорилирование регуляторных клеточных белков.
Пролактин после связывания с рецептором не активирует аденилатциклазу, его внутриклеточный посредник пока неизвестен.
Четвертый уровень репродуктивной системы представлен гипофизотропной зоной гипоталамуса, представляющей собой скопление нейронов в виде ядер вентро–, дорсомедиального и аркуатного. В гипоталамусе присутствуют два типа нейронов – крупноклеточные и мелкоклеточные. Тела крупноклеточных нейронов находятся в супраоптическом и паравентрикулярных ядрах, а их аксоны идут к срединному возвышению, вниз по ножке гипофиза к терминалям в задний доле гипофиза. Эти нейроны синтезируют и секретируют окситоцин и вазопрессин. Тела мелкоклеточных нейронов образуют скопления во многих гипоталамических ядрах. Они синтезируют нейрогормоны, которые стимулируют (либерины) или ингибируют (статины) выделение соответствующих тропных гормонов аденогипофиза. Либерины и статины по аксонам этих клеток поступают в терминали, находящиеся в срединном возвышении. Срединное возвышение является составной частью нейрогипофиза и представляет собой переход основания гипоталамуса в ножку гипофиза. Здесь содержится значительное количество терминалей гипоталамических и экстрагипоталамических нейронов, происходит перекрест нервных и гуморальных сигналов. Трансформация сигналов осуществляется благодаря связи терминалей секретирующих нейронов с капиллярами гипоталамо–гипофизарной портальной системы, а также через специфические клетки танициты, выстилающие дно 3–го желудочка.
Либерины и статины проникают в капилляры гипоталамо–гипофизарной портальной системы и переносятся в переднюю долю гипофиза. Кроме основного направления кровотока вниз по ножке гипофиза небольшой объем крови может поступать вверх по ножке, что важно для осуществления механизма обратной связи между гипофизом и гипоталамусом.
Выделен и хорошо изучен ЛГ–рилизинг–гормон (ЛГ–РГ, или люлиберин). Он представляет собой декапептид. Поскольку ЛГ–РГ способен стимулировать образование и выделение ЛГ и ФСГ, он получил название гонадолиберина (ГЛ). ЛГ–РГ у приматов и человека образуется в аркуатных ядрах медиобазального гипоталамуса, получивших название аркуатного осциллятора, так как секреция ЛГ–РГ генетически запрограммирована в определенном пульсирующем ритме с частотой примерно один раз в час. Этот ритм получил название цирхорального. Цирхоральный ритм выделения ЛГ–РГ формируется в пубертатном возрасте и является показателем зрелости нейросекреторных структур гипоталамуса. Считают, что в функции репродуктивной системы восстановление пульсирующего ритма ЛГ–РГ играет только пермиссивную (запускающую) роль, т.е. пульсирующая секреция ГЛ необходима лишь для индукции секреции ЛГ и ФСГ, а циклические изменения содержания ГТ в течение менструального цикла обеспечиваются механизмом обратной связи со стороны гормонов яичника.
Гонадолиберин стимулирует синтез и высвобождение гонадотропинов из депо в аденогипофизе после связывания со специфическими рецепторами на клеточной мембране гонадотрофов, что приводит к активации аденилатциклазы, образованию цАМФ и последующей стимуляции внутриклеточной системы Са2+ – кальмодулин.
Секреция ГЛ контролируется нейромедиаторами (нейротрансмиттерами) и простагландинами. Последнее подтверждается отсутствием пика секреции ЛГ и овуляции при использовании индометацина, подавляющего синтез простагландинов.
Регуляция секреции пролактина осуществляется, главным образом, пролактинингибирующим фактором (ПИФ), роль которого выполняет дофамин (ДА). Он вырабатывается дофаминергическими структурами в области срединного возвышения и по нейронам тубероинфундибулярной системы поступает в портальную сосудистую сеть. Дофамин тормозит выделение ПРЛ из лактотрофов гипофиза, а его антагонисты (резерпин, аминазин, метилдофа и др.) вызывают усиление выделения ПРЛ.
Выделить и установить структуру пролактолиберина не удалось. Однако известно, что при определенных условиях стимулировать выделение ПРЛ могут эстрогены, серотонин, гистамин, ?–аминомасляная кислота (ГАМК), тиреотропный гормон (ТТГ), ?–эндорфин, энкефалин (ЭНК), вазоинтестинальный полипептид. Физиологическими стимулами секреции ПРЛ являются сон, физическая активность, стресс, гипогликемия, раздражение соска молочной железы, половой акт, эстрогены.
Пятый уровень регуляции репродуктивной системы осуществляется на уровне коры головного мозга и экстрагипоталамических церебральных структур, воспринимающих импульсы из внешней среды, и интерорецепторов. Они передают импульсы через систему нейротрансмиттеров (НТ) в нейросекреторные ядра гипоталамуса по афферентным путям, которые подразделяются на восходящие и нисходящие. Восходящие пути к гипоталамусу идут из групп норадреналиновых, серотониновых и дофаминовых нейронов, рассеянных в акведуктном и перивентрикулярном сером веществе. Нисходящие пути идут от миндального ядра, гиппокампа, лимбической системы, сетчатки глаза. НТ являются основным связующим звеном между ЦНС и эндокринной системой и обеспечивают их единство в организме.
Классическими НТ являются катехоламины норадреналин (НА) и дофамин (ДА), ацетилхолин, ГАМК, серотонин, гистамин, морфиноподобные опиоидные нейропептиды. В качестве нейромедиаторов могут выступать ?–аминомасляная кислота (ГАМК) и катехолэстрогены.
Дофамину, норадреналину и серотонину принадлежит ведущая роль в контроле секреции гонадолиберина (ГЛ). Норадреналин стимулирует овуляторный выброс ГЛ, дофамин понижает цирхоральную секрецию ЛГ, серотонин опосредует тормозящее влияние на циклический выброс ГЛ.
Эндогенные опиоидные пептиды (ЭОП) образуются в результате расщепления предшественников, дающих начало 3 группам ЭОП: эндорфинам (ЭНД), энкефалинам (ЭНК) и динорфинам (ДИН). ?–ЭНД образуется при расщеплении проопиомеланокортина, в молекуле которого еще содержатся ?–липотропин, ?–, ?– и ?–меланоцитостимулирующий гормон и АКТГ. Предшественником ЭНК является препроэнкефалин, ДИН – препродинорфин.
Эндогенные опиоиды снижают частоту и амплитуду выброса ГЛ, что сопровождается снижением тонической секреции гонадотропинов, а также блокируют овуляторный выброс ФСГ и ЛГ; ?–ЭНД, ЭНК и их аналоги могут усиливать выброс ПРЛ путем стимуляции выделения серотонина и торможения освобождения ДА.
Имеются сведения об участии в регуляции гипоталамо–гипофизарной активности катехолэстрогенов (КЭ) – естественных производных эстрогенов. Они имеют структурное сходство как с эстрогенами, так и с катехоламинами и могут взаимодействовать с рецепторами катехоламинов и эстрогенов. Это позволяет рассматривать их в качестве модуляторов функциональной активности гипоталамуса.
Таким образом, регуляция репродуктивной системы представляет собой сложный процесс, включающий 5 уровней, каждый из которых регулируется вышележащими структурами и механизмом обратной связи. Выделяют длинную петлю обратной связи между гормонами яичника и ядрами гипоталамуса, между гормонами яичника и гипофизом; короткую петлю – между передней долей гипофиза и гипоталамусом и ультракороткую – между ГЛ и нейроцитами гипоталамуса. Обратная связь может быть положительной или отрицательной. Примером положительной обратной связи является овуляторный пик выброса ЛГ и ФСГ в ответ на максимальное содержание эстрадиола в крови, примером отрицательной – усиление выделения ЛГ в ответ на низкий уровень эстрадиола или увеличение образования ГЛ при снижении уровня ЛГ в клетках аденогипофиза. В течение фолликулярной фазы по мере увеличения концентрации Е2 усиливается его отрицательный обратный эффект на высвобождение ГТ.
В регуляции функции репродуктивной системы основными являются пульсирующая секреция ГЛ в нейронах гипоталамуса и регуляция выброса ЛГ и ФСГ эстрадиолом по механизму отрицательной и положительной обратной связи. На фоне фиксированных (цирхоральных) импульсов ГЛ у приматов и человека именно яичник играет роль биологических часов, а эстрадиол является основным гормоном, участвующим в обеспечении функциональных связей между звеньями репродуктивной системы.






