Классификация
Классификация аменореи представлена на рис. 5.8.
Аменорея может быть истинной и ложной. Истинная аменорея является следствием нарушения циклических процессов в системе гипоталамус – гипофиз – яичники – матка. При ложной аменорее (криптоменорее) циклические процессы в репродуктивной оси сохранены, но нарушено наружное выделение менструальной крови вследствие имеющегося препятствия на уровне шейки матки, влагалища или девственной плевы (атрезии или аплазии).
Истинная аменорея подразделяется на физиологическую и патологическую.
Физиологическая аменорея наблюдается у девочек в препубертатном периоде, у женщин репродуктивного возраста в период беременности и лактации; у пожилых женщин в постменопаузе.
Патологическая истинная аменорея по времени возникновения подразделяется на первичную и вторичную. Под первичной аменореей понимают отсутствие менструаций у девушек без вторичных половых признаков в 14 лет или у девушек с хорошо развитыми вторичными половыми признаками в 16 лет.
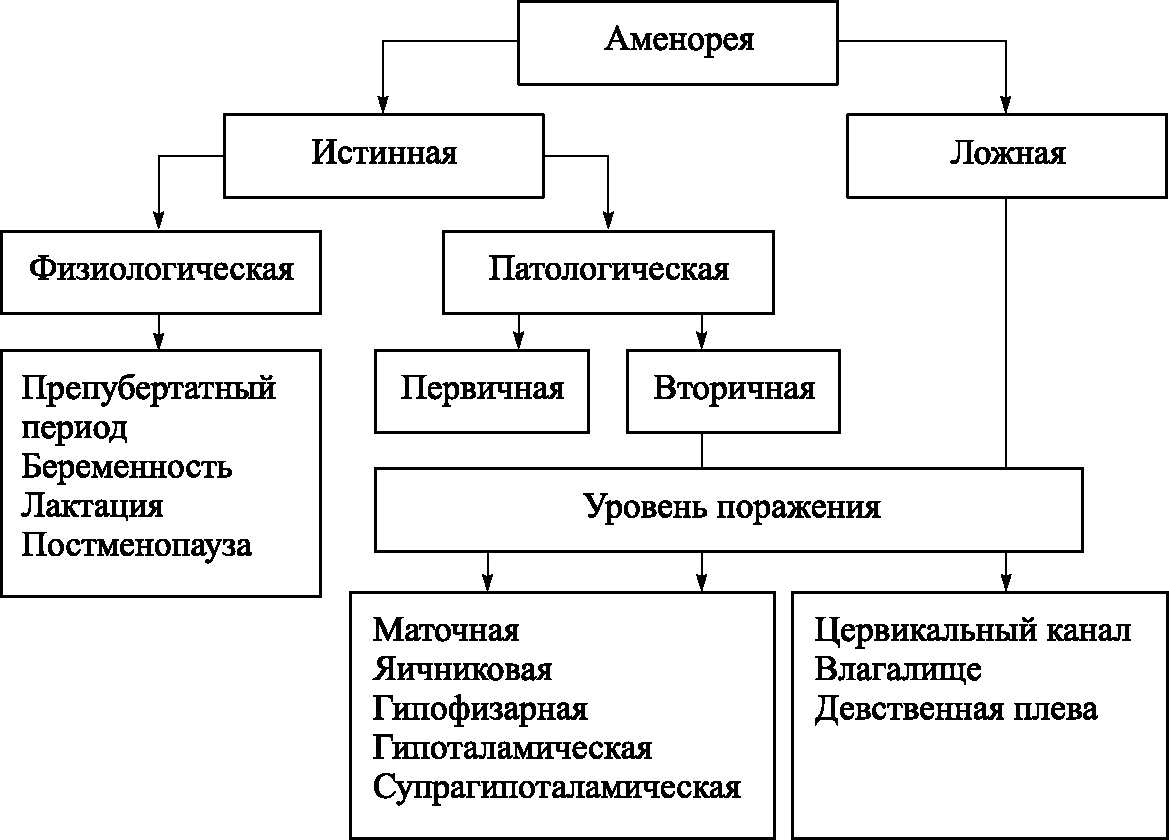
Рис. 5.8. Классификация аменореи
Вторичная аменорея – это отсутствие менструаций в течение 6 месяцев и более у женщин репродуктивного возраста с предшествующей нормальной менструальной функцией при отсутствии беременности.
По уровню поражения выделяют маточную, яичниковую, гипофизарную, гипоталамическую и супрагипоталамическую патологическую истинную аменорею.
Согласно классификации ВОЗ (1973), аменореи подразделяются по уровню гонадотропных гормонов на гипергонадотропные (гипергонадотропный гипогонадизм), гипогонадотропные (гипогонадотропный гипогонадизм гипофизарный или гипоталамический) и нормогонадотропные (нормогонадотропный гипогонадизм).
С практической точки зрения наиболее приемлемы клинико–этиологические классификации, которые учитывают причины развития и/или особенности клинической картины первичной и вторичной аменореи (Dewhurst, 1974; S.S.K. Yen, 1998; И.Б. Манухин и соавт., 2001; Вл.И. Дуда и соавт., 2002). Данные представлены в виде схемы на рис. 5.9. Так, среди аменорей (первичных) выделяют аменорею с задержкой и без задержки полового развития; низким, нормальным или высоким ростом; с явлениями гирсутизма; высоким или низким уровнем гонадотропинов и гиперпролактинемией.
Общие принципы обследования и лечения. При первичной аменорее в первую очередь исключается ложная аменорея. Для нее характерно развитие вторичных половых признаков (общий осмотр). При гинекологическом осмотре выявляется препятствие для оттока менструальной крови (сплошная девственная плева, перегородка во влагалище, атрезия цервикального канала), скопление крови выше препятствия с образованием гематокольпоса, гематометры, гематосальпинксов (ректальное исследование, УЗИ–сканирование, лапароскопия), нормальное анатомическое строение яичников (УЗИ).
Для диагностики истинной первичной аменореи проводятся следующие обследования.
? Общее клиническое обследование для исключения экстрагенитальных заболеваний, нарушения питания, патологии щитовидной железы.
? Оценка роста и типа телосложения (женский, мужской, интерсексуальный, евнухоидный, диспластичный). Низкий или карликовый рост может быть следствием низкой секреции гормона роста (гипофизарный гипопитуитаризм), метаболических нарушений при болезни почек, синдроме мальабсорбции, при типичной форме дисгенезии гонад (синдром Шерешевского – Тернера). В последнем случае имеются характерные соматические аномалии. Низкий рост в сочетании с признаками маскулинизации характерен для врожденной формы адреногенитального синдрома. Высокий рост может быть при усилении продукции гормона роста (аденома гипофиза), чистой форме дисгенезии гонад, гипогонадотропом гипогонадизме.
? Степень и последовательность развития вторичных половых признаков (молочные железы – половое оволосение – менархе) и гениталий. Отсутствие или слабое развитие молочных желез и полового оволосения, недоразвитие половых органов чаще являются следствием дисгенезии гонад, но могут быть и при гипоталамическом и гипофизарном гипогонадизме. Хорошо развитые молочные железы, отсутствие полового оволосения и матки, слепое влагалище характерны для тестикулярной феминизации. Нормальное соматическое и половое развитие, отсутствие матки, слепое влагалище являются признаками синдрома Рокитанского.
? Ультразвуковое сканирование малого таза позволяет выявить наличие или отсутствие яичников, матки; оценить их строение (размеры и наличие фолликулярного аппарата в яичниках, размеры матки, состояние эндометрия).
? Генетическое обследование проводится при первичной аменорее, когда имеются аномалии развития полового аппарата и/или соматические отклонения. Исследуются половой хроматин и кариотип. Половой хроматин очень низкий при кариотипе, содержащем У–хромосому.
? Гормональное исследование заключается в определении уровня ФСГ, ЛГ и пролактина: высокий уровень ФСГ наблюдается при первичном поражении яичников, низкий – при первичной недостаточности гипофиза, нормальный чаще бывает при функциональных гипоталамических нарушениях. Нарушение соотношения ЛГ и ФСГ характерно для синдрома поликистозных яичников (СПКЯ). При высоком уровне пролактина показано определение уровня Т3, Т4, ТТГ для исключения первичного гипотиреоза. При гирсутизме исследуется уровень тестостерона в плазме крови или экскреция с мочой 17–КС.
? Рентгенологическое обследование, компьютерная (КТ) или магнитно–резонансная томография (МРТ) проводятся для исключения опухолей, расположенных в области турецкого седла или супраселлярно. Его обязательно проводят при повышении уровня пролактина или при клиническом подозрении на опухоль. Внутривенную урографию следует произвести при всех случаях врожденных пороков развития матки и влагалища, так как они часто сочетаются с аномалиями мочеточников и почек.
? Лапароскопия с биопсией гонад проводится в тех случаях, когда неинвазивные методы не позволяют точно установить их природу (яичник или яичко) или когда необходимо определить, есть ли примордиальные фолликулы и овоциты в яичнике. Реже к лапароскопии прибегают для установления наличия матки при атрезии влагалища. Возможно лапароскопическое удаление дисгенетичных гонад, особенно у больных, имеющих в кариотипе У–хромосому, или яичек при тестикулярной феминизации после формирования вторичных половых признаков в связи с высоким риском роста дисгерминомы.
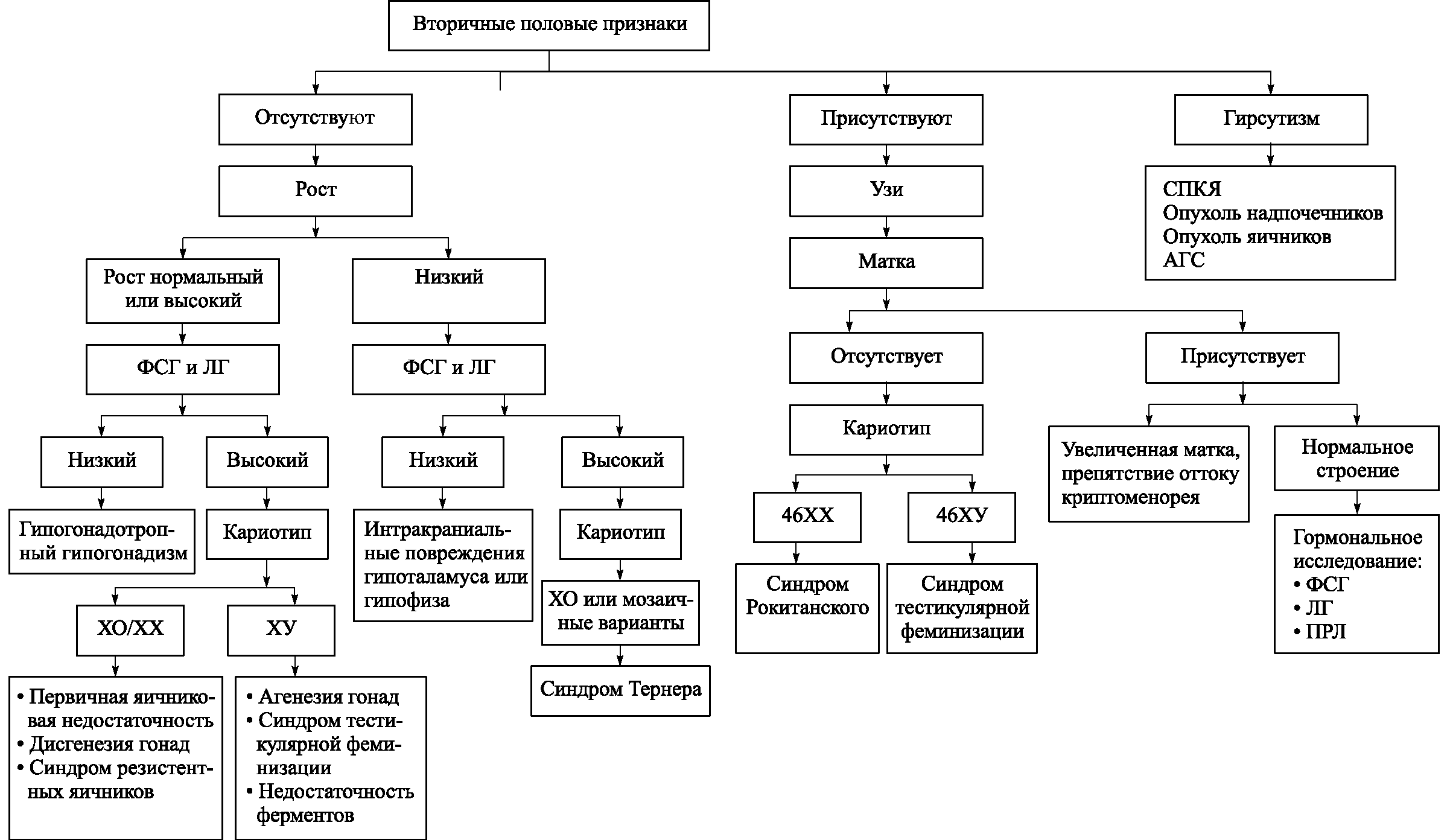
Рис. 5.9. Клинико–этиологическая классификация и алгоритм обследования больных с первичной аменореей:
ФСГ – фолликулостимулирующий гормон; ЛГ – лютеинизирующий гормон; КТ – компьютерная томография; МРТ – магнитно–резонансная томография; ПРЛ – пролатин; Т3 – трийодтиронин; Т4 – тироксин; ТТГ – тиреотропный гормон; СПКЯ – синдром поликистозных яичников; АГС – адреногенитальный синдром
Алгоритм обследования больных с первичной аменореей представлен на рис. 5.9.
Обычно больные с вторичной аменореей имеют матку, влагалище, эндометрий, который отвечает на введение половых стероидных гормонов, и яичники, реагирующие на введение гонадотропинов. Во всех случаях вторичной аменореи в первую очередь следует исключить беременность.
Порядок обследования больных с вторичной аменореей включает проведение следующих мероприятий.
? Оценка особенностей предшествующей менструальной функции; информация о перенесенных ранее операциях на органах малого таза и приеме лекарств.
? Выявление обстоятельств, касающихся изменений в социальном и эмоциональном окружении больной, воздействия каких–либо стрессовых факторов, в том числе тяжелой физической нагрузки и ограничений диеты.
? Проведение общего медицинского обследования с целью выявления хронических заболеваний.
? Оценка телосложения, массы тела, характера роста волос, состояния молочных желез и органов малого таза, функции щитовидной железы.
? Исследование содержания гормонов и оценка уровня поражения гипоталамо–гипофизарно–яичниковой системы: уровни ФСГ, ЛГ и яичниковых гормонов низкие при гипоталамической или гипофизарной недостаточности; при яичниковой недостаточности уровни гонадотропинов, особенно ФСГ, высокие; нарушение соотношения ФСГ и ЛГ в сторону увеличения последнего (1:3) и увеличение уровня тестостерона подтверждают наличие болезни или синдрома ПКЯ.
? Проведение проб: с прогестероном и циклической с эстрогенами и прогестероном.
? Для подтверждения маточной аменореи – проба с гонадотропинами; для подтверждения гипоталамо–гипофизарного уровня поражения – проба с гонадолиберином.
? Ультразвуковое сканирование для уточнения состояния эндометрия и фолликулярного аппарата яичников.
? Компьютерная или магнитно–резонансная томография с целью визуализации гипофизарной ямки и исключения селлярных и супраселлярных опухолей.
? Гистероскопия для уточнения природы маточной аменореи (синдром Ашермана, туберкулезный эндометрит) и оценки состояния эндометрия.
? Лапароскопия с биопсией яичников с целью дифференциальной диагностики синдромов преждевременного истощения яичников (отсутствуют примордиальные фолликулы) и резистентных яичников.
? Консультация специалистов (невропатолога, психиатра, эндокринолога, терапевта). Алгоритм определения уровня поражения при аменорее представлен на рис. 5.10.
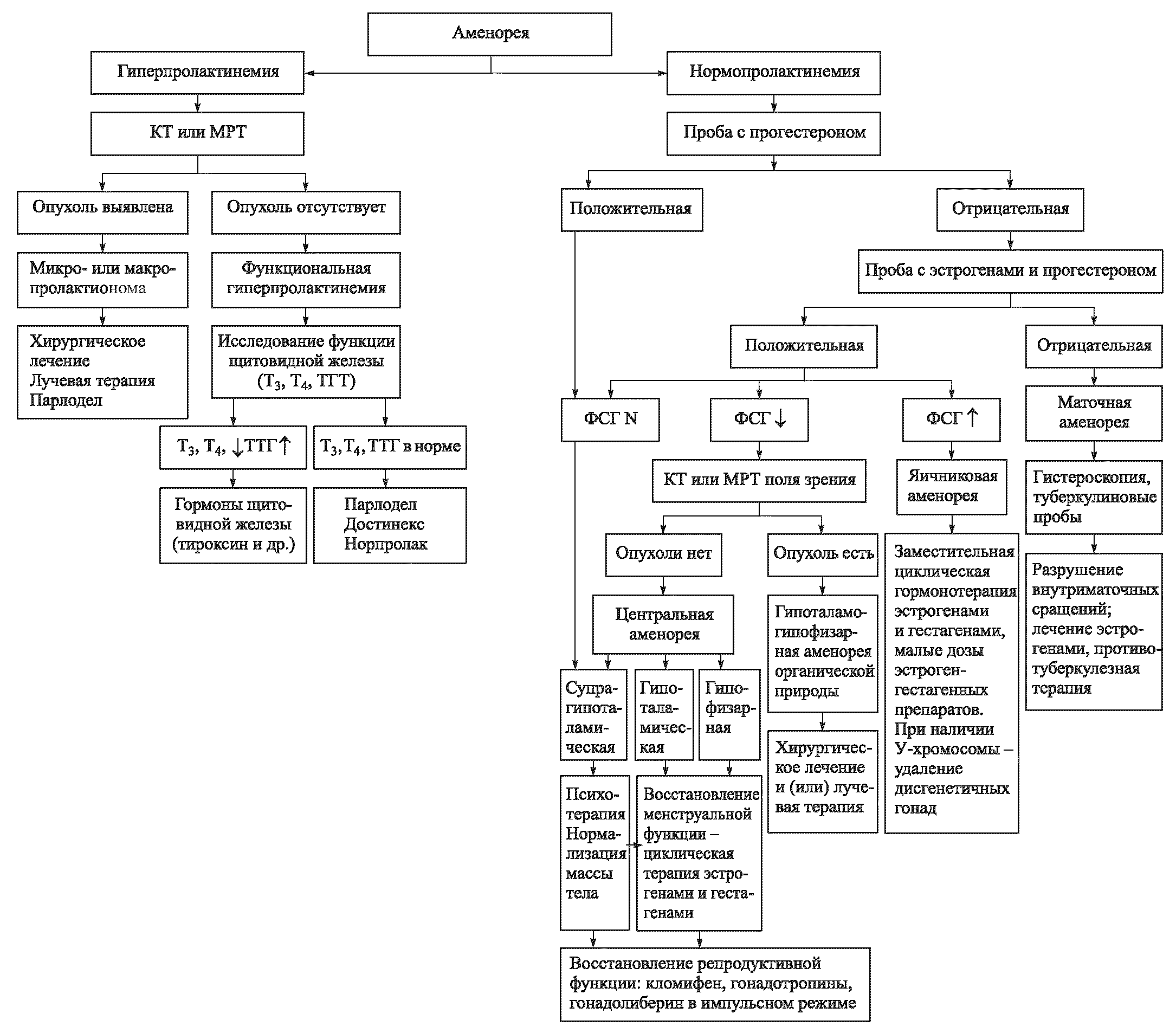
Рис. 5.10. Алгоритм определения уровня поражения выбора метода терапии при аменорее: N – норма; J. – пониженный уровень; f – повышенный уровень
Лечение больных аменореей должно проводиться с учетом причины и уровня поражения репродуктивной системы гипоталамус – гипофиз – яичники – матка.
При центральной аменорее, обусловленной опухолью, расположенной в области турецкого седла или супраселлярно, показано хирургическое лечение (чаще транссфеноидальная аденомэктомия) и/или лучевая терапия; при пролактиноме иногда проводится лечение парлоделом. Если причиной аменореи являются последствия перенесенной нейроинфекции, травмы, то назначается противовоспалительное и рассасывающее (алоэ, ФиБС, гумизоль) лечение; проводят эндоназальную гальванизацию с витамином В1 или ионами кальция; назаначают препараты, улучшающие интракраниальный кровоток и метаболические процессы в мозге и снижающие внутричерепную гипертензию (циннаризин, танакан, ноотропил, актовегин, верошпирон).
При гипофункции щитовидной железы проводится лечение тироксином по 0,05–0,1 мг; при гиперплазии надпочечников, связанной с дефицитом фермента 21–гидроксилазы, – дексаметазоном по 0,5 мг под контролем уровня 17–ОН–прогестерона, при функциональной гиперпролактинемии – агонистами ДА (парлодел, норпролак, достинекс).
Для лечения психогенно–стрессовых аменорей необходимо устранение стрессорного фактора (в том числе повышенных физических нагрузок), нормализация массы тела; показана психотерапия. Эти мероприятия сами по себе могут привести к восстановлению менструальной функции.
Гормональное лечение включает назначение половых стероидных гормонов (эстрогенов и прогестерона), кломифена, гонадотропинов и аналогов гонадолиберина (см. рис. 5.10).
Циклическая заместительная гормональная терапия эстрогенами и гестагенами показана, в первую очередь, больным с яичниковой аменореей. При первичной аменорее сначала назначают эстрогены (микрофоллин, прогинова, эстрофем – по 1–2 таблетки в день в течение 21 дня) для стимуляции вторичных половых признаков, роста матки (если она есть) и эндометрия, закрытия зон роста костей, после чего переходят на циклический прием эстрогенов и гестагенов (дюфастон – 20 мг, утрожестан – 200 мг, провера – 20 мг, норколут – 5–10 мг) или комбинированных препаратов (циклопрогинова, дивина, фемостон, трирегол, триквилар), содержащих небольшие дозы этих гормонов. Гормональная терапия проводится практически пожизненно, поэтому через каждые 6 месяцев желательно делать перерыв на 1–2 месяца с назначением гепатопротекторов и витаминов. Циклическая терапия половыми стероидами назначается также при центральных формах аменореи (гипоталамической и гипофизарной) для восстановления менструальной функции.
Восстановление репродуктивной функции при агенезии и дисгенезии гонад, тестикулярной феминизации невозможно. В этих случаях при наличии матки восстановление фертильности достигается оплодотворением донорской яйцеклетки.
Гонадотропины (меногон, пурегон, метродин, хорагон) назначают при гипофизарной аменорее, главным образом для восстановления репродуктивной функции.
При гипоталамической или психогенной аменорее для восстановления репродуктивной функции методом выбора является использование аналогов гонадолиберина (бусерелин, лютрелеф), которые вводятся в импульсном режиме с помощью аппарата «Цикломат» внутривенно или подкожно каждые 60, 90 или 120 мин или в виде спрея интраназально каждые 2 ч.
Антиэстроген кломифен может применяться при функциональной психогенной аменорее для стимуляции овуляции по общепринятой методике. При отсутствии эффекта показано введение гонадолиберина в импульсном режиме.
Лечение маточной аменореи, не связанной с отсутствием матки, заключается в разрушении внутриматочных сращений, введении протектора для предупреждения повторного образования спаек и назначении эстрогенов для стимуляции роста оставшихся островков эндометрия. При аменорее, вызванной туберкулезным эндометритом, показано специфическое лечение. Прогноз в отношении восстановления менструальной и репродуктивной функции неблагоприятный.
Первичная аменорея без задержки полового развития. В основе ложной аменореи лежит нарушение оттока менструальной крови вследствие врожденных аномалий развития полового тракта (отсутствие отверстия в девственной плеве, загименальная перегородка, поперечная перегородка влагалища в нижней, средней или верхней трети, аплазия части или всего влагалища) или атрезии цервикального канала, влагалища, гимена в результате перенесенного воспалительного процесса. Менструальная кровь, не находя выхода, скапливается выше препятствия, и со временем развиваются гематокольпос, гематометра, гематосальпинкс.
При атрезии гимена больные жалуются на периодически ноющие боли, возникающие и усиливающиеся в определенные дни, совпадающие с менструацией, в области промежности, в низу живота. Скопление больших количеств крови во влагалище может привести к нарушению мочеиспускания и дефекации. При аплазии части влагалища боли носят схваткообразный характер, интенсивность их нарастает: сначала боли появляются периодически, а с течением времени становятся постоянными. Болевой синдром может быть обусловлен и развитием эндометриоза, который обнаруживается у 70% девочек с пороками развития гениталий.
Иногда наблюдается повышение температуры тела до 37–37,8 °С вследствие всасывания пирогенных веществ из мест скопления крови или при ее инфицировании.
Вторичные половые признаки появляются своевременно, хорошо выражены, наружные половые органы развиты нормально.
Диагноз ставится на основании осмотра наружных половых органов. При атрезии гимена можно увидеть отсутствие отверстия в нем, просвечивающуюся опухоль цианотичного цвета, выбухание всей промежности. При ректальном исследовании в случаях атрезии гимена и аплазии части влагалища в малом тазу или за его пределами определяется опухолевидное образование тугоэластической консистенции (гематокольпос) размерами с 6–7–месячную беременность. Над гематокольпосом можно пропальпировать матку.
При аплазии части влагалища размеры гематокольпоса меньше, определение матки затруднено из–за развития гематометры. При аплазии всего влагалища и функционирующей матке на месте влагалища пальпируется тяж, а в малом тазу определяется увеличенная плотная болезненная матка (гематометра). Сбоку от матки может пальпироваться гематосальпинкс.
Диагноз уточняется с помощью ультразвукового исследования органов малого таза, иногда лапароскопически.
Лечение атрезии гимена хирургическое: производится рассечение гимена крестообразным разрезом 2*2 см, удаляется скопившаяся во влагалище кровь, затем формируются края отверстия путем наложения одиночных или непрерывного обвивного шва.
При частичной аплазии влагалища перед хирургическим лечением проводится вытяжение тканей с помощью кольпоэлонгатора.
Аплазия всего влагалища является показанием для создания искусственного влагалища. Однако, если аплазия влагалища сочетается с отсутствием шейки матки или цервикального канала, рекомендуется удаление матки в период полового созревания и проведение операции по созданию искусственного влагалища перед замужеством.
Маточная аменорея может быть обусловлена патологией развития эндометрия, снижением чувствительности его рецепторов к половым стероидам или деструкцией всей слизистой оболочки, чаще всего вследствие туберкулезного процесса.
Недостаточность эндометрия («немой» цикл, «немая» менструация) проявляется отсутствием менструации при сохранении циклических процессов в гипоталамо–гипофизарно–яичниковой системе. Причина патологии точно не установлена. Для клинической картины этой формы аменореи характерно нормальное соматическое и половое развитие, правильное строение наружных и внутренних половых органов. Тесты функциональной диагностики подтверждают наличие циклических изменений гормонального фона и овуляции. Однако в ответ на спад гормонов слизистая оболочка матки не отторгается, а подвергается бессимптомной инволюции. Репродуктивная функция не нарушается, проведения лечения не требуется.
Деструкция эндометрия в большинстве случаев бывает связана с перенесенным туберкулезным эндометритом и образованием фиброзных внутриматочных сращений (синдром Ашермана).
Для подтверждения диагноза необходимо проведение туберкулиновых проб, биопсии эндометрия под контролем гистероскопа с последующим морфологическим исследованием соскоба (выявляются туберкуломы и казеозные очаги). Гистеросальпингография выявляет грубые дефекты наполнения, обусловленные внутриматочными синехиями, и изменения маточных труб, указывающие на сальпингит специфической этиологии. Больным проводится общее противотуберкулезное лечение.
Для дифференциальной диагностики с другими формами аменорей используется прогестероновая проба. При отсутствии менструальноподобной реакции в ответ на введение прогестерона проводится комбинированная проба с эстрогенами и прогестероном. Отрицательная проба подтверждает маточную форму аменореи.
Для синдрома Майер – Рокитанского – Кюстнера характерно врожденное отсутствие (аплазия) матки и влагалища.
Дефект мюллеровых ходов приводит к недоразвитию или отсутствию средней части маточных труб, матки и верхнего отдела влагалища. Возможен вариант сочетания аплазии влагалища с рудиментарной солидной двойной маткой в виде тонких соединительнотканных шнуров. От рогов матки часто отходят гипопластичные трубы. Яичники нормально развиты и расположены в типичном месте. Гипоталамо–гипофизарно–яичниковая система функционирует нормально.
Больные обращаются к врачу в связи с первичной аменореей, невозможностью или болями при попытке полового сношения. При осмотре отмечается нормальный женский фенотип, хорошо развитые вторичные половые признаки. Наружные половые органы сформированы правильно. Иногда сохраняется незначительное углубление (2–3 см) между большими половыми губами (нижняя треть влагалища формируется из урогенитального синуса). При ректальном исследовании матка не определяется.
Диагностика основывается на данных клинической картины и дополнительных методов обследования. УЗИ подтверждает отсутствие матки, нормальное расположение и строение яичников. Содержание ФСГ и ЛГ в сыворотке крови в пределах нормы. Отмечаются циклические колебания уровня гонадотропинов и половых стероидных гормонов. Кариотип женский (46ХХ), содержание полового хроматина в норме. При лапароскопии яичники и фимбриальные концы маточных труб выглядят нормально. Сами трубы постепенно уменьшаются в диаметре и смыкаются по средней линии в виде горизонтального тканевого тяжа, располагающегося между мочевым пузырем и прямой кишкой. У 30–50% больных могут быть аномалии развития почек и мочевыводящих путей, поэтому им показана экскреторная урография.
Лечение. Для обеспечения нормальной половой жизни проводится хирургическое лечение (кольпопоэз). Восстановление менструальной и репродуктивной функции у больных невозможно.
Первичная аменорея с задержкой полового развития – аменорея, обусловленная нарушением развития гонад (первичная яичниковая или гипергонадотропная аменорея или гипергонадотропный гипогонадизм).
В структуре первичной аменореи дисгенезия гонад, при которой отсутствует гормонопродуцирующая ткань яичников, составляет около 30%. В результате дефицита эстрогенов отсутствует отрицательная обратная связь, что сопровождается резким увеличением секреции гонадотропинов. В основе дисгенезии гонад лежат хромосомные аномалии: от изменения количества половых хромосом до их структурных дефектов (делеции, транслокации). При выпадении гена Х–хромосомы, детерминирующего рост тела в длину, отмечается низкорослость.
Синдром Шерешевского – Тернера (типичная форма дисгенезии гонад) развивается при отсутствии одной Х–хромосомы.
При данном синдроме в эмбриональном периоде герминативные клетки вначале мигрируют в гонадные валики, но затем гибнут, вследствие чего отсутствуют функционирующие половые железы. Формируются незрелые внутренние и наружные половые органы по женскому типу, так как их дифференцировка происходит автономно, независимо от состояния гонад.
Частота синдрома Шерешевского – Тернера составляет 1:2000–1:7000 рождений. По данным ВОЗ, заболевание встречается почти у 0,02% родившихся живыми и почти в 4% случаев самопроизвольных выкидышей. Наследование заболевания не доказано.
Для больных с хромосомным набором 45ХО характерными симптомами уже при рождении являются низкая масса тела (2000–2300) при доношенной беременности, короткая шея с крыловидными складками кожи, низкая граница роста волос на затылке. Иногда обнаруживается лимфатический отек тыльной поверхности кистей и стоп. В детском и школьном возрасте отмечаются замедленный рост, отсутствие полового созревания.
У взрослых больных низкий рост (120–140 см) и диспластичное телосложение: бочкообразная грудная клетка с широко расставленными сосками молочных желез, короткая шея с кожными складками (шея сфинкса), вальгусная девиация локтевых и коленных суставов, разболтанность суставов, полая стопа, могут быть пороки развития пальцев кистей и ногтевых выемок, остеодистрофия. При осмотре можно выявить птоз, эпикантус, антимонголоидный разрез глаз, косоглазие, низко посаженные уши, высокое нёбо. Рентгенологически выявляются остеодистрофия и остеопороз губчатых костей таза, позвоночника, черепа. Костный возраст может незначительно отставать от календарного.
Вторичные половые признаки у больных не появляются: молочные железы отсутствуют, соски мягкие, слабо пигментированы. Оволосение в подмышечных впадинах и на лобке скудное (Ах1_2, Р ). Большие и малые половые губы гипопластичны, клитор развит слабо. Влагалище и матка резко недоразвиты, слизистая их атрофична. Менструации отсутствуют (первичная аменорея).
У больных может наблюдаться патология щитовидной железы (аутоиммунный тиреоидит), пороки развития почек, мочевого пузыря, мочеточников, стеноз перешейка аорты.
Наряду с типичной клинической картиной синдрома Шерешевского – Тернера существуют другие варианты, что объясняется широким диапазоном хромосомных аномалий: наличием мозаицизма с кариотипами ХО/ХХ, ХО/ХУ, ХО/ХХХ, а также структурных аберраций Х–хромосомы (изохромосома по короткому или длинному плечу, делеция длинного или короткого плеча Х–хромосомы) при кариотипе 46ХХ.
Так, при мозаицизме ХО/ХУ развивается синдром Шерешевского – Тернера с маскулинизацией: у больных наблюдается увеличение клитора и рост волос по мужскому типу. Стертые формы синдрома без выраженных соматических аномалий и с умеренной задержкой полового развития возможны при мозаицизме 45ХО/46ХХ с высоким процентом нормального клона или при структурной аберрации Х–хромосомы. Описаны единичные случаи появления менструаций у таких больных и даже наступление беременности.
Диагностика заболевания строится на основании клинических признаков, перечисленных выше, и подтверждается дополнительными методами.
Важным в постановке диагноза является исследование кариотипа и полового хроматина. Последний отсутствует при кариотипе 45ХО или снижен до 4–10% при мозаицизме 45ХО/46ХХ.
Ультразвуковое исследование выявляет на месте внутренних гениталий резко гипопластичную матку, на месте яичников – тяжи, расположенные у входа в малый таз, либо зачатки гонад без фолликулярного аппарата.
Лапароскопически обнаруживается рудиментарная или резко гипопластичная матка и рудиментарные гонады в виде белых, тонких соединительнотканных тяжей или тонких пластинок.
Во влагалищных мазках отмечается картина атрофии (преобладают базальные и парабазальные клетки), шеечный индекс 1–2 балла, симптомы «зрачка» и «папоротника» отрицательные, что свидетельствует о резко выраженной гипоэстрогении. В крови определяются высокие уровни гонадотропинов, особенно ФСГ. Содержание эстрогенов резко снижено.
Чистая форма дисгенезии гонад возникает в более поздние сроки эмбриогенеза (6–12–я неделя внутриутробного развития). Ее причинами могут быть хромосомные аберрации, генные мутации или эмбриотоксические факторы. В случае формирования дисгенетического яичника (кариотип 46ХХ; половой хроматин в норме) фенотип остается женским. Неполноценность яичников проявляется лишь в период пубертата в виде гипогонадизма.
При дисгенезии яичек (кариотип 46ХУ, половой хроматин отсутствует) не обеспечивается регресс мюллеровых ходов и нормальная маскулинизация наружных половых органов. Это ведет к развитию матки, маточных труб, влагалища и бисексуальному строению наружных гениталий.
Первичная аменорея и инфантилизм сопровождаются нормальным или высоким ростом. У больных отмечается интерсексуальное или евнухоидное телосложение с увеличением окружности грудной клетки, фенотип женский. Соматические аномалии отсутствуют.
Вторичные половые признаки отсутствуют или недостаточно развиты: молочные железы гипопластичны, оволосение в подмышечных и лобковой областях скудное. Отмечается резко выраженное недоразвитие наружных половых органов и матки.
Диагностика учитывает уровни гормонов. Уровень ФСГ в 8–15 раз и ЛГ – в 4–5 раз превышает норму, содержание эстрогенов резко снижено. Кольпоцитологически определяется атрофический тип мазка. Экскреция 17–КС нормальная.
При ультразвуковом сканировании яичники не определяются, матка резко гипопластична или вместо нее визуализируется тяж.
Лапароскопически выявляется женский тип внутренних половых органов (гипопластичная матка и трубы), на месте яичников – тонкие белесоватые образования.
Кариотип у больных чаще всего 46ХХ и 46ХУ Половой хроматин при кариотипе 46ХУ отсутствует, при женском кариотипе (46ХХ) содержание его может быть нормальным.
Этиология и патогенез смешанной формы дисгенезии гонад окончательно не выяснены. Возможно, вследствие патологии половых хромосом нарушается дифференцировка яичек, развивается их функциональная недостаточность, проявляющаяся в эмбриогенезе.
При этой особой форме дисгенезии гонад на одной стороне обнаруживают рудиментарный тяж, не функционирующий как яичник, на другой – дисгенетическое яичко с различно выраженной гормональной активностью, что и определяет фенотип и строение половых органов. У больных выделяются различные варианты кариотипов: ХО /ХУ, ХУ, но чаще всего определяется мозаицизм типа ХО/ХУ
Клинические проявления зависят от процентного соотношения нормального и аберрантного клона клеток. Для больных характерен женский, реже мужской фенотип, интерсексуальное строение наружных половых органов с преобладанием женского типа, наличие гипопластичных влагалища и матки (не происходит рассасывание мюллеровых производных).
Рост больных нормальный, но может быть его задержка. Молочные железы отсутствуют. Имеется гипертрофия клитора, часто сохраняется урогенитальный синус. В некоторых случаях в пубертатном периоде проявляется маскулинизация: оволосение по мужскому типу, гипертрихоз, низкий тембр голоса.
Соматические аномалии отсутствуют.
Диагностика основывается на данных клинической картины, УЗИ (матка в виде тяжа), лапароскопии (обнаруживается недоразвитая матка, со стороны рудиментарного белесоватого тяжа – маточная труба, со стороны дисгенетичного яичка – семенной канатик или маточная труба). Яичко может находиться на месте яичника, в паховом канале, иногда – в рудиментарной мошонке. Отмечается склонность к малигнизации.
Половой хроматин резко снижен до 3–7% или отрицательный.
При гормональном исследовании отмечается повышение содержания андрогенов; уровень гонадотропинов резко повышен, а эстрогенов резко снижен.
Первичная яичниковая недостаточность, не связанная с патологией половых хромосом, может быть следствием длительного действия различных повреждающих факторов (интоксикация, инфекция, радиация и др.) в период эмбриогенеза, что ведет к замедлению структурной и функциональной дифференциации яичника вплоть до гибели герминативных элементов.
Чаще всего яичниковую недостаточность вызывают паротит (особенно в фетальном и пубертатном периодах) и коревая краснуха.
Первичная яичниковая недостаточность может быть обусловлена нечувствительностью морфологически полноценных яичников к эндогенной гонадотропной стимуляции (синдром резистентных яичников), а также врожденным дефектом фермента 17а–гидроксилазы, что ведет к нарушению продукции стероидов надпочечниками и яичниками, включая глюкокортикоиды, андрогены и эстрогены. Дефицит половых стероидов является причиной полового инфантилизма и первичной аменореи, а избыток продукции дезоксикортикостерона в надпочечниках приводит к развитию артериальной гипертензии.
Отсутствие или резкое снижение гормональной функции яичников приводит к увеличению секреции гонадотропинов. Уровень ФСГ в 5–6,5 раза, а ЛГ в 1,5–2 раза превышает предовуляторный пик в менструальном цикле женщины репродуктивного возраста. Может усиливаться секреция соматотропина, что отражается на соматическом развитии в пубертатном периоде: высокий рост с преобладанием продольных размеров тела, узкая грудная клетка, узкий таз, длинные конечности.
Для данной группы больных характерны отсутствие менструаций, резко выраженный половой инфантилизм. Молочные железы неразвиты, половое оволосение слабо выражено. При гинекологическом осмотре выявляются недоразвитие и слабая пигментация больших и малых половых губ, гимен тонкий, кольцевидный, отмечается сухость вульвы и слизистой входа во влагалище. Влагалище узкое, складчатость его стенок не выражена. Матка маленькая, круглая, шейка длинная. В редких случаях у больных при недостаточности фермента 17а–гидроксилазы в яичнике имеются примордиальные фолликулы, которые на определенном этапе синтезируют эстрогены, что обусловливает развитие молочных желез и появление нескольких менструальноподобных кровотечений, поэтому чаще всего таких пациенток относят к больным со вторичной аменореей.
Для диагностики применяют тесты. Тесты функциональной диагностики свидетельствуют о резко выраженной эстрогенной недостаточности: симптомы «зрачка» и «папоротника» отрицательные, шеечный индекс составляет 1–3 балла, в мазке парабазальные клетки составляют 70–80%.
Уровень гонадотропинов в крови высокий. Экскреция эстрогенов снижена, прегнандиол не определяется.
У больных с синдром недостаточности 17а–гидроксилазы отмечается повышение образования 17–ОН–прогестерона и дезоксикортикостерона надпочечниками.
При рентгенологическом исследовании выявляется отставание костного возраста от календарного.
УЗИ выявляет значительное уменьшение размеров матки и яичников вплоть до полного отсутствия последних. Расположение яичников более высокое – на уровне входа в малый таз. Кариотип женский – 46ХХ.
Лечение больных с первичной яичниковой аменореей проводится заместительной терапей половыми гормонами. Лечение следует начинать как можно раньше, с 10–12 лет. Это способствует устранению диспропорционального соматического развития, уменьшению проявлений полового инфантилизма, улучшению нервно–психического состояния больных, обеспечению накопления массы костной ткани, наиболее приближенному к физиологическому процессу.
На 1–м этапе в течение нескольких месяцев (от 2 до
? назначают только эстрогены для стимуляции развития вторичных половых признаков, формирования фигуры по женскому типу, увеличения размеров матки и стимуляции пролиферации эндометрия. При нормальном росте используются небольшие, а при высоком росте – большие дозы эстрогенов (микрофоллин по 0,05 мг или 0,2–0,25 мг соответственно) для ускорения закрытия зон роста. Рекомендуется использовать препараты, содержащие природные (прогинова, эстрофем, дивигель) или конъюгированные (премарин) эстрогены в течение 21 дня каждого месяца. Высокорослым больным с низким костным возрастом для быстрого появления вторичных половых признаков и замедления роста предпочтение следует отдать дивитрену (содержит 70 таблеток эстрадиола валерата по 2 мг; 14 таблеток эстрадиола валерата в сочетании медроксипрогестерона ацетатом по 20 мг и 7 таблеток плацебо).
После развития вторичных половых признаков или при появлении менструальноподобной реакции переходят на циклическую гормональную терапию: в течение 21 дня назначают эстрогены, затем 7 дней гестагены (дюфастон – по 20 мг, утрожестан – по 200 мг, норколут – по 5–10 мг в день). После 25 лет допустимо назначение моно– или трехфазных комбинированных эстроген–гестагенных препаратов.
Лечение следует проводить в течение всего детородного периода под наблюдением врача с УЗИ–контролем.
У больных с низким ростом (синдром Шерешевского – Тернера) на 1–м этапе проводят терапию по стимуляции роста. С этой целью используют гормоны щитовидной железы (тиреоидин, тиреокомб по 50–100 мг), анаболические стероиды (нероболил по 1 мл 1 раз в месяц илиретаболил по 1 мл 1 раз в 3 месяца внутримышечно курсами по 4–5 месяцев с перерывами в 2–3 месяца), аналоги гормона роста (генотропин), инсулинотерапию. Имеются данные о том, что заместительная терапия натуральными эстрогенами, начатая в возрасте 14–18 лет, существенно не влияет на закрытие зон роста костей, поэтому может быть применена у низкорослых пациенток.
Хирургическое лечение (удаление рудиментарных тяжей гонад) показано при дисгенезии гонад, если в кариотипе больных имеется У–хромосома или ее фрагменты, а также при подозрении на развитие опухоли гонады (гонадобластомы или дисгерминомы) у больных с кариотипами 45ХО, 46ХХ или их мозаичными вариантами. При гистологическом подтверждении злокачественности процесса в удаленной гонаде гормонотерапия не проводится. Возможно применение фитоэстрогенов, которые не обладают пролиферативной активностью. Воспитание детей проводится с ориентацией на женский пол.
В случае смешанной дисгенезии гонад при мужской соматической и психической ориентации яичко, расположенное в мошонке, следует оставить. При женском типе строения наружных половых органов и соответствии психики соматическому виду яичко удаляется, проводится пластика молочных желез и влагалища.
Синдром тестикулярной феминизации (ложный мужской гермафродитизм) – это аутосомное заболевание с рецессивным наследованием, связанным с полом (передается по женской линии). Частота патологии составляет 1 случай на 20.000 всех живорожденных.
В основе заболевания лежит отсутствие или врожденный дефект рецепторов андрогенов в органах–мишенях, а также генетически обусловленный дефект фермента 5а–редуктазы, превращающей тестостерон в дигидротестостерон. Последний обеспечивает развитие полового оволосения и вирилизацию половых органов. В результате нечувствительности или отсутствия периферических рецепторов андрогенов в тканях–мишенях у лиц мужского пола с кариотипом 46ХУ, нормально развитыми и продуцирующими тестостерон яичками формируется женский фенотип.
Нарушения развития начинаются на 3–м месяце внутриутробного развития. Наличие У–хромосомы обеспечивает формирование тестикул. Стимуляция яичек хорионическим гонадотропином вызывает в них образование тестостерона и тормозящей мюллеровой субстанции (гормон эмбрионального тестикула), которая подавляет развитие мюллеровых протоков и формирование маточных труб и матки. Развития вольфовых протоков и мужских гениталий также не происходит, несмотря на присутствие тестостерона, так как его рецепторы либо отсутствуют, либо не функционируют. В результате происходит запрограммированное развитие плода с наружными женскими гениталиями. К моменту рождения яички могут оставаться в брюшной полости, вырабатывают тестостерон в концентрациях, соответствующих норме для мужчин, но действие его не проявляется из–за дефекта рецепторов. Часть тестостерона ароматизируется в печени и жировой ткани в эстрогены, количество которых достаточно для развития молочных желез и распределения жира по женскому типу.
Различают полную и неполную формы тестикулярной феминизации.
При полной форме во время полового созревания у внешне нормальных девочек начинают развиваться молочные железы, однако рост волос на лобке и в подмышечных впадинах отсутствует. Наблюдается первичная аменорея.
Наружные половые органы развиты по женскому типу. Влагалище укорочено, заканчивается слепо. Матка отсутствует, у 1/3 больных располагаются в брюшной полости, у 50–60% больных – в паховых каналах, являясь содержимым врожденной паховой грыжи, у остальных – в толще больших половых губ.
УЗИ подтверждает отсутствие матки. При лапароскопии в брюшной полости обнаруживаются яички в виде круглых образований, меньших, чем яичники размеров, с гладкой сероватой оболочкой, мягкой консистенции. Матка и трубы отсутствуют.
Уровни ФСГ и ЛГ в плазме крови могут быть нормальными или высокими (результат отсутствия отрицательной обратной связи), содержание тестостерона соответствует верхней границе нормы для мужчин. Кариотип нормальный мужской 46ХУ, половой хроматин резко снижен (меньше 6%).
При неполной форме синдрома тестикулярной феминизации частично сохранен рецепторный аппарат и его чувствительность к андрогенам в тканях–мишенях, поэтому у больных проявляются признаки вирилизации: морфограмма мужского типа; строение наружных половых органов неопределенное: клитор увеличен, происходит слияние больших половых губ, остается урогенитальный синус. Матка и маточные трубы отсутствуют. В период полового созревания развивается гипертрихоз. Молочные железы слабо развиты. Яички обычно находятся в брюшной полости.
Лечение комплексное. Больные растут и воспитываются как девочки. Их не следует информировать о том, что по хромосомному набору и гормональной характеристике они относятся к мужскому полу. Замужество и нормальная половая жизнь возможны, менструальная и репродуктивная функции исключаются.
В связи с высоким риском малигнизации яички следует удалять при полной форме после завершения роста и развития молочных желез в 16–18 лет, при неполной – до периода полового созревания с целью предотвращения вирилизации. При неполной форме проводится хирургическая коррекция наружных половых органов: удаление клитора, рассечение наружной стенки урогенитального синуса, при необходимости – пластика влагалища.
В дальнейшем проводится заместительная гормональная терапия эстрогенами для развития вторичной половых признаков, предупреждения посткастрационного синдрома, атрофии молочных желез, слизистой вульвы и влагалища, остеопороза, сердечно–сосудистых осложнений. В дальнейшем возможно применение низко– и микродозированных эстроген–гестагенных препаратов (регулон, фемоден, силест, логест, мерсилон).
Гипофизарный гипогонадотропный гипогонадизм, как правило, возникает при органическом поражении области турецкого седла, реже является следствием функциональных (биохимических) нарушений. При этом может наблюдаться избирательное нарушение синтеза ?–цепей с изолированной недостаточностью ФСГ и ЛГ или ?–цепей, что приводит к недостаточности продукции ФСГ, ЛГ и ТТГ.
Клиническая картина гипофизарного гипогонадотропного гипогонадизма при нарушении продукции только ФСГ и ЛГ (недостаточность ?–цепей) не отличается от таковой при гипоталамическом гипогонадотропном гипогонадизме.
При нарушении синтеза ?–цепей имеются клинические признаки вторичного гипотиреоза.
При гормональном обследовании выявляется недостаточность ФСГ и ЛГ почти до полного их отсутствия, гипоэстрогения. Проба с гонадотропными гормонами положительна.
Лечение обычно начинают с заместительной терапии половыми стероидами до полового развития. Для стимуляции овуляции и восстановления репродуктивной функции используются менопаузальные гонадотропины – меногон, менопур (содержат ФСГ и ЛГ по 75 МЕ) или рекомбинантные аналоги ФСГ (пурегон, гонал–Ф). Их вводят под контролем фолликулометрии и определения уровня эстрогенов в сыворотке крови. По достижении доминантным фолликулом диаметра 18–20 мм вводится овуляторная доза ЧХГ (профази, хорагон) или рекомбинантных аналогов ЛГ (луверис) или ХГ (овитрел). Длительное использование гонадотропинов нежелательно, так как может вызвать появление к ним антител.
Гипоталамический гипогонадотропный гипогонадизм (синдром Kallmann, ольфактогенитальная дисплазия, гипогонадотропный евнухоидизм) был описан в 1944 г. Kallmann. Синдром, включающий гипогонадотропный гипогонадизм и аносмию. В большинстве случаев этот синдром передается по наследству как аутосомно–доминантный признак, но описаны случаи и аутосомно–рецессивного наследования. Дефектный ген локализуется в Х–хромосоме.
В основе развития синдрома лежит изолированная гипоталамическая недостаточность гонадолиберина, которая приводит к избирательному нарушению секреции ФСГ и ЛГ в гипофизе и, тем самым, к гипогонадизму. При аутопсии у больных находят анатомические признаки частичной или полной агенезии обонятельной луковицы.
У больных с женским генотипом не наступает полового созревания, наблюдаются первичная аменорея, нарушение обоняния. Рост больных высокий, так как на фоне дефицита эстрогенов тормозится закрытие эпифизарных зон роста. Тип телосложения евнухоидный. Наружные и внутренние половые органы гипопластичны.
Обследование выявляет очень низкие, практически не поддающиеся определению уровни ФСГ и ЛГ в плазме крови. Содержание эстрогенов резко снижено. Проба с гонадолиберином положительная.
Яичники инфантильные по внешнему виду и морфологической картине: в основном выявляются примордиальные фолликулы; рост и развитие предполостных фолликулов замедлен.
Рентгенограмма черепа в пределах нормы.
Лечение проводится заместительной терапией эстрогенами для стимуляции развития вторичных половых признаков и торможения роста. Восстановление репродуктивной функции достигается прерывистым введением аналогов гонадолиберина (бусерелин) в средней дозе 5 мкг на импульс с интервалами 60–120 мин.
Гипоталамический гипопитуитаризм в последние годы встречается все чаще. Этиологическими факторами патологии могут быть опухоли (краниофарингиома, эктопическая пинеалома, глиома, рак желточного мешка, тератома), инфильтративные заболевания (эозинофильная гранулема или болезнь Хенда – Шюллера – Крисчена, саркоидоз), инфекции (менингит, туберкулез), травмы головы, в том числе родовые, перенесенная анте– или интранатально гипоксия.
В основе развития гипопитуитаризма в описанных выше случаях может лежать нарушение обмена нейротрансмиттеров, выработки или доставки гипоталамических рилизинг–гормонов или ингибинов в переднюю долю или вазопрессина в заднюю долю гипофиза.
Клиническими признаками гипоталамического гипопитуитаризма, наряду с симптомами, связанными с дефицитом гонадотропинов (нарушение развития вторичных половых признаков, генитальный инфантилизм), могут быть: несахарный диабет; умеренное повышение уровня пролактина на фоне снижения других гормонов гипофиза; зрительные нарушения; задержка роста при действии патологического фактора в детском возрасте; возможно ожирение; выраженная сонливость; головные боли; нарушение психики у некоторых больных.
При обследовании, в первую очередь, необходимо исключить опухоли (рентгенография, КТ или МРТ черепа). Положительная проба с гонадолиберином подтверждает гипоталамический генез заболевания.
Выбор лечения определяется причиной гипоталамического гипопитуитаризма. При опухолях показано оперативное лечение и/или лучевая терапия, при воспалении – противовоспалительное. Проводятся мероприятия, направленные на нормализацию функции диэнцефальной области (совместно с невропатологом, психоневрологом). Назначается общеукрепляющая терапия: диета с учетом исходной массы тела, циклический прием витаминов (фолиевой кислоты по 0,02 г и глутаминовой кислоты по 0,25 г 3 раза в день в условную 1–ю фазу цикла, витамина С по 1,0 г и витамина Е по 100 мг в день во 2–ю фазу). Показана эндоназальная гальванизация с ионами кальция, тиамином, воротниковой зоны – с 2% раствором новокаина; при выраженной гипоплазии матки – тепловые процедуры на низ живота для усиления кровоснабжения органов малого таза.
Для стимуляции полового развития, восстановления менструальной функции назначается циклическая гормональная терапия, которая проводится по общепринятым схемам с 12– 13 лет. Применение малых доз эстрогенов оказывает стимулирующее влияние на образование и выделение гонадолиберина и гонадотропинов. Для стимуляции овуляции назначают гонадолиберин в импульсном режиме. При недостаточности соматотропный функции назначают соматотропин, анаболики (инозин, оротат калия), при несахарном диабете – вазопрессин.
Вторичная аменорея. Вторичная аменорея составляет 75% в структуре аменорей. Она является частым симптомом нарушения функции не только гипоталамо–гипофизарно–яичниковой системы, но и надпочечников, щитовидной железы, при нарушении функции которых на долю вторичной аменореи приходится около 50%.
Ложная аменорея является следствием травматических манипуляций, выскабливаний, при которых происходит повреждение базальной мембраны эндоцервикса, атрезия цервикального канала и нарушение оттока менструальной крови.
Вторичная аменорея развивается после медицинского аборта, диагностического выскабливания, удаления полипов. Характерной жалобой являются циклические боли схваткообразного характера в дни ожидаемой менструации.
Диагноз строится на данных анамнеза, клинической картины, УЗИ, произведенного при болях, которое выявляет расширение полости матки и скопление в ней жидкости.
Лечение заключается в восстановлении проходимости цервикального канала при зондировании.
Причинами вторичной маточной аменореи являются повторные выскабливания или аблация слизистой оболочки матки, воздействие прижигающих веществ (йод, жидкий азот), послеродовые и послеоперационные осложнения, воспалительные процессы различной этиологии, которые могут привести к образованию синехий между передней и задней стенками и повлечь за собой частичную или реже полную облитерацию полости матки. Циклические процессы в яичнике сохраняются, эндокринные нарушения не наблюдаются.
У нормально эстрогенизированных больных появляется вторичная аменорея после воздействия факторов, перечисленных выше. Могут сохраняться субъективные ощущения циклических изменений в организме.
Диагностика базируется на данных гормонального исследования, свидетельствующих о сохранении функции яичников и тропной стимуляции гипофиза. Содержание ФСГ и ЛГ в плазме крови нормальное, отмечается их пик в середине цикла. Уровень пролактина в пределах нормы. Концентрации эстрадиола и прогестерона соответствуют фазам цикла. Гормональные пробы с прогестероном и циклическим назначением эстрогенов и прогестерона отрицательные.
При ультразвуковом исследовании эндометрий истончен. Метросальпингограмма выявляет внутриматочные синехии. Гистероскопия производится для оценки состояния эндометрия, уточнения характера и расположения внутриматочных сращений.
При подозрении на инфекционный, часто туберкулезный, генез внутриматочных синехий производится выскабливание с последующим морфологическим, бактериоскопическим и бактериологическим исследованием.
Лечение зависит от этиологического фактора. Внутриматочные синехии разрушают под контролем гистероскопа, после чего вводят ВМС на 2–3 месяца и назначают циклическую гормональную и антибактериальную терапию. Туберкулезный эндометрит является показанием для проведения специфической терапии в условиях противотуберкулезного диспансера.
Вторичная яичниковая аменорея может быть следствием нечувствительности яичников к гонадотропинам, преждевременного их истощения, болезни поликистозных яичников, андрогенпродуцирующих опухолей, гнойного расплавления яичников (двухсторонние пиовары, туберкулезный процесс), ятрогенных причин (хирургическое удаление яичников, облучение, лечение цитостатиками).
При синдроме резистентных яичников (СРЯ) у больных с яичниками нормального строения отсутствует реакция фолликулярного аппарата на гонадотропины. Частота патологии составляет от 3,4 до 10% среди всех форм аменореи. Развивается у женщин моложе 35 лет.
Этиология и патогенез СРЯ не установлены. Среди этиологических факторов, способствующих развитию СРЯ, упоминаются инфекции (туберкулез, паротит, саркоидоз, актиномикоз), операции на яичниках, использование иммунодепрессантов, цитостатиков, радио– и рентгенотерапии, аутоиммунные заболевания (болезнь Хашимото, миастения, алопеция, гипопаратиреоз, злокачественная анемия и др.).
В основе патологии лежит дефект рецепторного аппарата яичников, его рефрактерность к ФСГ. Нечувствительность рецепторов может быть связана с их блокадой антиовариальными антителами (при аутоиммунных заболеваниях) или с локальными яичниковыми регуляторами (полипептидным фактором, тормозящим связывание ФСГ с рецепторами; ингибитором лютеинизации гранулезных и тека–клеток; ингибитором созревания овоцита). Не исключается возможность аномальности самой молекулы ФСГ, при которой сохраняется ее иммунологическая активность, но отсутствует биологическая.
Для больных с СРЯ характерен отягощенный семейный анамнез (нарушение менструальной функции по типу аменореи и олигоменореи), низкая масса тела при рождении (у 85%), большое число (до
? перенесенных инфекционных заболеваний в детстве.
Менархе обычно наступает своевременно, но через 5–10 лет возникает аменорея, развитие которой больные связывают со стрессом, тяжелыми вирусными инфекциями, приемом больших доз сульфаниламидов. На фоне аменореи эпизодически могут появляться менструации. Беременность и роды бывают редко (только у 5% больных).
При осмотре больные с СРЯ имеет правильное телосложение, с развитыми вторичными половыми признаками. Часто наблюдается железисто–кистозная мастопатия.
При гинекологическом осмотре отмечается истончение вульвы и слизистой влагалища. При ультразвуковом сканировании размеры матки нормальные или несколько уменьшены, эндометрий тонкий, яичники средней величины со множеством фолликулов диаметром до 5–6 мм.
Диагноз подтверждают лапароскопия, биопсия и морфологическое исследование ткани яичника (наличие в них примордиальных и преантральных фолликулов), высокие уровни ФСГ и ЛГ и низкие уровни эстрогенов в плазме крови.
Вспомогательное значение имеют гормональные пробы: проба с прогестероном сначала часто положительная, в последующем – отрицательная; циклическая проба с эстрогенами и прогестероном или микродозами (1/4 таблетки) эстроген–гестагенных препаратов положительная; проба с гонадотропинами и кломифеном отрицательная.
Кариотип женский (46ХХ), половой хроматин нормальный.
Лечение комплексное. Менструальная функция восстанавливается при назначении заместительной циклической терапии эстрогенами и гестагенами или комбинированными эстроген–гестагенными препаратами. На начальных этапах заболевания при положительной гестаген–кломифеновой пробе продолжают лечение кломифеном; при положительной пробе с гестагенами и отрицательной с кломифеном последний назначают в сочетании с хорионическим гонадотропином.
Данные о лечении бесплодия у больных СРЯ большими дозами гонадотропинов противоречивы. Отмечено увеличение размеров фолликулов и появление материальноподобных выделений. Однако рост фолликулов не сопровождается увеличением уровня эстрогенов в крови.
Имеется информация о положительных результатах лечения аналогами гонадолиберина, попытках восстановления репродуктивной функции путем экстракорпорального оплодотворения донорской яйцеклетки.
При выявлении аутоиммунного процесса проводят лечение кортикостероидами и циклоспорином.
Синдром истощения яичников (СИЯ) – это вариант вторичной яичниковой аменореи, развивающийся у женщин моложе 38 лет с нормальной менструальной и репродуктивной функцией в прошлом и сопровождающийся клиническими симптомами климактерического синдрома (приливы жара, сухость слизистой влагалища, диспареуния и др.). В структуре вторичных аменорей частота СИЯ составляет около 10%.
СИЯ рассматривается как мультифакторное заболевание, в основе которого могут лежать хромосомные аномалии и действие патологических средовых факторов, приводящих к формированию яичников с врожденным дефицитом фолликулярного аппарата или к его деструкции в пре– и постпубертатном периоде. Среди таких факторов упоминается радиация, лекарственные и химические вещества, неблагоприятное течение беременности, вирус гриппа, краснухи, паротита, гемолитический стрептококк, неполноценное питание, авитаминозы, тяжелые инфекционные и соматические заболевания. У больных отягощен семейный анамнез: у близких родственниц часто отмечаются нарушения менструальной функции, такие как аменорея, олигоменорея, позднее менархе, ранний климакс. СИЯ может развиваться после субтотальной резекции яичников, особенно при апоплексии.
Вследствие действия средовых факторов у больных с генетической предрасположенностью происходит истощение запаса фолликулов в яичниках и замещение их соединительной тканью, апоптоз гормонально–активных клеток. Яичники перестают функционировать, прекращаются менструации, наступает ранняя менопауза. На фоне низкого уровня эстрогенов отсутствует отрицательная обратная связь, что приводит к увеличению секреции гонадотропинов, особенно ФСГ.
Клиническая картина при СИЯ определяется дефицитом эстрогенов и напоминает климактерический синдром.
Менархе у больных с СИЯ, как правило, наступает своевременно, менструальная и репродуктивная функции сохраняются в течение 12–20 лет и прекращаются в возрасте до 38 лет. Через 1–2 месяца после наступления аменореи появляются приливы жара, нервно–психические расстройства, затем сухость во влагалище, диспареуния и другие симптомы, характерные для постменопаузального синдрома.
Фенотип у больных типичный женский, генотип 46ХХ, половой хроматин в пределах нормы. Отмечается гипоплазия матки, резкое уменьшение размеров яичников. Тесты функциональной диагностики свидетельствуют о выраженной гипоэстрогении: симптом «зрачка» отрицательный, КПИ 0–10%. При ультразвуковом сканировании размеры матки меньше нормы, эндометрий истончен, яичники маленькие, без фолликулов. Содержание эстрадиола в крови ниже нормы, уровень ФСГ в 15 раз, а ЛГ в 4 раза превышает их базальный уровень. Концентрация пролактина снижена. Пробы с прогестероном, гонадотропинами, кломифеном отрицательные, проба с эстрогенами и прогестероном положительная.
Окончательный диагноз ставится на основании лапароскопии и биопсии яичников: выявляются маленькие, морщинистые яичники желтого цвета; фолликулы в них отсутствуют.
Лечение гормональное. Больным с СИЯ показана заместительная гормональная терапия по меньшей мере до возраста естественной менопаузы. Предпочтительна циклическая терапия натуральными эстрогенами (прогинова, дивигель) и производными прогестерона (медроксипрогестерона ацетат, дюфастон) или использование комбинированных препаратов (дивина, фемостон, климен). Заместительная гормональная терапия не только ликвидирует вазомоторные и нервно–психические симптомы, но является профилактикой атрофических процессов в мочеполовом аппарате и коже, сердечно–сосудистых расстройств, остеопороза.
Прогноз относительно восстановления репродуктивной функции неблагоприятный. Беременность возможна при экстракорпоральном оплодотворении донорских яйцеклеток спермой мужа с последующим их переносом в предварительно подготовленную в течение 3–4 циклов матку. До 16–20 недель беременности назначаются препараты прогестерона (дюфастон, утрожестан).
Вторичная гипофизарная аменорея может быть следствием хирургического или лучевого разрушения гипофиза, развития крупных (обычно нефункционирующих) опухолей, инфарктов, инфильтрирующих и грануломатозных процессов. Клинические проявления возникают при повреждении 70% ткани гипофиза. Ранние проявления гипофункции гипофиза можно установить только при проведении проб с рилизинг–гормонами. Развитие гормональной недостаточности обычно происходит в определенной последовательности: сначала нарушается гонадотропная функция гипофиза, затем снижается уровень гормона роста, ТТГ, АКТГ и пролактина.
Наибольшее практическое значение имеют инфаркты гипофиза: идиопатические (встречаются в конце репродуктивного периода или в период менопаузы); у больных с диабетическим васкулитом или серповидно–клеточной анемией, но чаще связанные с послеродовыми кровотечениями и шоком (синдром Шихена).
Послеродовой гипопитуитаризм (синдром Шихена) описан в 1939 г. Sheehan (синдром гипопитуитаризма, развившегося вследствие острого некроза передней доли гипофиза, вызванного послеродовым кровотечением и шоком).
Некроз аденогипофиза развивается вследствие тромбоза сосудов гипофиза на фоне глубокой гипотензии и гиповолемии при тяжелых послеродовых кровотечениях.
В результате некроза передней доли гипофиза наблюдается нарушение продукции тропных гормонов. Степень гипопитуитаризма может быть различной: от полного прекращения до неадекватно низкой секреции гонадотропинов, АКТГ, ТТГ, гормона роста и пролактина.
В зависимости от степени нарушения функции аденогипофиза синдром Шихена может протекать в тяжелой и легкой, скрытой форме и проявляться при воздействии дополнительных стрессовых факторов (повторные роды, инфекция, травма). Симптомы определяются недостаточностью гормонов периферических желез: надпочечников, щитовидной железы, яичников.
При массивном некрозе гипофиза клинические проявления развиваются быстро. Первым признаком является инволюция молочных желез и отсутствие лактации в послеродовом периоде. Возникают астения, апатия, артериальная гипотензия, головная боль, головокружения, обмороки. Затем выпадают волосы на лобке и в подмышечных впадинах, отмечаются анорексия, тошнота, рвота, запоры, атрофия молочных желез, гипоплазия полового аппарата, аменорея; дистрофические изменения ногтей и зубов; выпадение волос. Может развиться гипопитуитарная кома: упорная астения, резкая гипотензия, брадикардия, сонливость, сильная зябкость, безразличие к окружающей обстановке, гипотермия, гипогликемия, микседема. Если своевременно не диагностировать это состояние и своевременно не лечить, может наступить смерть.
Тесты функциональной диагностики свидетельствуют о резко выраженной недостаточности эстрогенов (симптомы «зрачка» и «папоротника» отрицательные, во влагалищном мазке преобладают парабазальные клетки – 60–80%). Гормональные исследования выявляют снижение уровня тропных гормонов: ФСГ, ЛГ, АКТГ, ТТГ, гормона роста, пролактина и гормонов периферических желез: эстрадиола, Т3, Т4, кортизола, андрогенов. Проведение проб с рилизинг–гормонами важно для оценки степени повреждения гипофиза и прогнозирования состояния больных.
Для исключения опухоли гипофиза показана рентгенография черепа.
Лечение должно быть направлено, в первую очередь, на улучшение общего состояния больной. С этой целью назначается заместительная терапия гормонами щитовидной железы (тиреоидин по 0,05 г в день) и кортикостероидами (гидрокортизон по 25 мг, преднизолон по 5 мг в день). В качестве анаболического гормона можно назначать метилтестостерон или неробол (ретаболил) при выраженной астении. Показана высококалорийная пища, витамины (аскорбиновая кислота, тиамин, ретинол, токоферола ацетат, эргокальциферол).
Восстановление менструальной функции имеет психологическое значение и осуществляется назначением циклической терапии эстрогенами и прогестероном женщинам репродуктивного возраста.
При гипопитуитарной коме внутривенно вводят гидрокортизон по 100–300 мг/сут или кортизон по 25 мг каждые 4–6 ч, 20% растворы глюкозы – 200–300 мл, строфантин, кордиамин, дофамин.
В основе гипофизарной кахексии (болезни Симмондса) лежит атрофия или некроз гипофиза, которые могут быть следствием воспаления (туберкулез, сифилис, нейроинфекция), травмы или деструкции опухолью. В результате нарушается секреция тропных гормонов с выпадением функции периферических желез: щитовидной, надпочечников, яичников. Поражение вентромедиальных ядер гипоталамуса приводит к развитию кахексии.
Клиническая картина напоминает таковую при синдроме Шихена и связана с гипофункцией коры надпочечников, щитовидной железы и яичников. Кроме того, отмечается плохой аппетит вплоть до полной анорексии, потеря в весе до 3–6 кг в месяц, резко выраженная анемия и кахексия: отсутствие подкожной клетчатки и атрофия мышц сначала на лице, верхней половине туловища, затем на нижней.
Результаты гормонального исследования такие же, как при синдроме Шихена.
Лечение при опухоли хирургическое и/или лучевое, при инфекционном процессе – специфическое противовоспалительное. Гормональная коррекция проводится гормонами периферических желез (см. синдром Шихена). Общеукрепляющая терапия включает назначение витаминов А, С, D, Е и группы В.
Аменорея при опухолях гипофиза встречается редко. Аденомы гипофиза составляют 10% всех внутричерепных опухолей, но многие из них малы и не проявляются клинически, а выявляются только при КТ. Аденомы, секретирующие один или несколько полипептидных гормонов, составляют 85% гипофизарных опухолей. Они могут достигать больших размеров и располагаться интра–, супра– и параселлярно. Наиболее известны опухоли, секретирующие полипептидные гормоны: АКТГ, пролактин, гормон роста. С 1970 г. появляются публикации о существовании аденом из клеток, секретирующих избыток гликопротеидных гормонов – ТТГ, ЛГ, ФСГ и различные их субъединицы, а также ?–эндорфин. ТТГ, ЛГ, ФСГ–секретирующие опухоли встречаются редко. Более распространены опухоли, образующие ?–субъединицу этих гормонов, при которых клинические симптомы отсутствуют.
Снижение активности передней доли гипофиза часто сопутствует опухоли гипофиза, обычно доброкачественной, которая оказывает компрессионное действие на здоровые клетки или прерывает связи между гипофизом и портальной системой, доставляющей рилизинг–гормоны из гипоталамуса. Медленно растущая аденома приводит к эрозии клиновидной кости и расширению турецкого седла.
Наибольшее практическое значение имеют аденомы, секретирующие полипептидные гормоны.
Аменорея встречается и при болезни Иценко – Кушинга. Заболевание обусловлено избыточной продукцией АКТГ аденомой из кортикотрофов гипофиза и вторичной гиперфункцией коры надпочечников. Гиперпродукция глюкокортикоидных и андрогенных гормонов приводит к развитию характерных клинических симптомов. Аменорея при этом связана с избытком андрогенов, которые подавляют в яичнике рост фолликулов и вызывают их атрезию, а также с подавлением секреции ФСГ по механизму обратной связи.
Для больных с данной патологией характерно ожирение с избыточным отложением жира в области лица, шеи (жировой горб), верхней половины туловища и живота при относительно худых конечностях. Лицо лунообразное, багрово–красного цвета с синюшным оттенком. На коже молочных желез, живота, бедер видны синюшно–багровые стрии; на коже лица, грудной клетки – угревые высыпания. Отмечается умеренно выраженный рост волос на лице, туловище, конечностях. На голове волосы выпадают. У больных развиваются артериальная гипертензия, гипергликемия (стероидный диабет), остеопороз (чаще позвоночника, ребер), дисфункциональные кровотечения, затем аменорея. Из неврологических расстройств бывают головная боль, нарушение сна, иногда развивается депрессия.
Расстройства зрения наблюдаются при опухоли больших размеров, растущей супраселлярно.
При диагностике учитывают клинические проявления и результаты обследования. При гинекологическом осмотре выявляются гиперпигментация наружных половых органов, внутренней поверхности бедер, скудный рост волос на лобке. Матка обычного размера, иногда увеличена, реже уменьшена.
Тесты функциональной диагностики констатируют умеренную гипоэстрогению (слабоположительные симптомы «зрачка» и «папоротника», КПИ около 40%), отсутствие циклических изменений (монофазная базальная температура). При гормональном исследовании определяется значительное увеличение уровня АКТГ, кортизола, умеренное – тестостерона, ДЭА. Обязательно исследование полей зрения, сужение которых отмечается при супраселлярном росте опухоли из–за сдавления перекреста зрительного нерва. Проба с дексаметазоном отрицательная. Подтверждает диагноз опухоли КТ или МРТ во фронтальной проекции.
Лечение заключается в хирургическом (транссфеноидальном) удалении аденомы с сохранением, по возможности, непораженной части гипофиза. Допустимо проведение лучевой терапии, назначение ингибиторов синтеза глюкокортикоидов: метирапона, блокирующего 11–гидроксилирование кортизола; кетоконазола, хлодитана. При тяжелой форме заболевания прибегают к двухсторонней адреналэктомии с последующей заместительной терапией.
Аменорея отмечается при акромегалии и гигантизме. Наиболее частым этиологическим фактором является доброкачественная, медленно растущая опухоль из соматотрофов, продуцирующая гормон роста (ГР). При росте опухоли в детском и подростковом возрасте развивается гигантизм. У взрослых, когда зоны роста костей уже закрыты, ГР действует на хондроциты, стимулирует повышение инсулиноподобного фактора роста – 1 (ИПФР–1), что ведет к расширению костей, особенно черепа и дистальных отделов конечностей; утолщению кожи, гипертрофии и гиперфункции ее придатков (увеличению продукции кожного сала); кардиомегалии, функциональной и анатомической гипертрофии почек. Бывает гипертензия с развитием в нелеченых случаях застойной сердечной недостаточности. Изменения костей нарушают действие сил, поддерживающих тело, что способствует развитию остеоартроза, особенно коленного сустава. Противоинсулиновый эффект ГР вызывает развитие клинической картины сахарного диабета. Некоторые аденомы, секретирующие ГР, выратабатывают также пролактин. Увеличение уровня последнего также может быть следствием нарушения опухолью связи лактотрофов с портальной системой, через которую поступает дофамин.
Утрата гонадотропной функции гипофиза с развитием аменореи и атрофических процессов во влагалище на фоне низкого уровня ФСГ является частым и ранним признаком растущего в турецком седле образования. Кортикотропная и тиреотропная функции гипофиза, как правило, сохранены.
Для гигантизма характерен высокий рост (более 190 см) при нормальных пропорциях тела. В отличие от синдрома Марфана (заболевания с доминантным типом наследования, при котором отмечаются пороки развития сердечно–сосудистой системы, вывих хрусталика, слабое развитие мышц, паукообразные пальцы) соматические аномалии при гигантизме отсутствуют.
При акромегалии происходит постепенное изменение черт лица и появляется необходимость носить обувь, перчатки, шляпу большего размера. Черты лица становятся грубыми: увеличивается нос, нижняя челюсть и надбровные дуги выступают вперед. Кожа жирная, отмечаются макроглоссия, широкие промежутки между зубами. Из–за утолщения голосовых связок голос становится грубым. Увеличиваются дистальные отделы конечностей – кисти, стопы; утолщаются пальцы. Появляется ночная полиурия. Один из ранних симптомов – прекращение месячных и сухость влагалища.
Диагостику проводят с помощью лабораторных и инструментальных методов обследования.
Лабораторное обследование выявляет увеличение уровня глюкозы в крови, резкое увеличение содержания ГР, снижение ФСГ, умеренное увеличение ИПФР–1, иногда пролактина.
Диагноз подтверждается рентгенологически или с помощью МРТ: выявляются увеличение размеров, расширение входа, углубление дна турецкого седла с эрозией его стенок.
Лечение должно быть направлено на уменьшение размеров аденомы, снижение уровня ГР до нормы и замещение утраченных функций гипофиза. Первое достигается хирургическим лечением и проведением лучевой терапии. Некоторые больные реагируют на лечение агонистами дофамина (бромокриптином). Эффект от лечения наступает при снижении уровня ГР до 3 нг/мл и ниже: снижаются АД, уровень глюкозы, уменьшается припухлость рук, ног, но изменения костей сохраняются.
После хирургического или лучевого лечения, которое, как правило, приводит к развитию пангипопитуитаризма, назначается заместительная терапия гормонами щитовидной железы, кортикостероидами и половыми стероидами.
Аменорея наблюдается при пролактинсекретирующих аденомах гипофиза. Распространенность пролактинсекретирующих аденом гипофиза в последние годы возросла, что может быть связано как с действием неблагоприятных экологических факторов, так и с улучшением диагностики. Пролактин–секретирующие аденомы делятся на микро– (до 1 см в диаметре) и макропролактиномы (более 1 см в диаметре). Пролактиномы составляют около 40% всех опухолей гипофиза, размеры большинства – менее 1 см.
Избыточная секреция опухолью пролактина приводит к нарушению менструальной функции вплоть до развития аменореи. Имеются клинические и лабораторные доказательства того, что пролактин может действовать непосредственно на гонады, гипофиз или гипоталамус. На уровне яичника высокие концентрации пролактина тормозят синтез прогестерона и эстрогенов, нарушают нормальное созревание фолликулов, по–видимому, в результате конкурентного связывания с рецепторами гонадотропинов. На уровне гипофиза происходит торможение секреции гонадотропинов и блокада спонтанного пика секреции ЛГ. При гиперпролактинемии снижается чувствительность гипоталамуса к эстрогенам и ингибируется выделение гонадолиберина.
Основными клиническими симптомами являются аменорея и галакторея. Другие симптомы, такие как быстрое увеличение массы тела, ожирение, головная боль, не являются специфичными. При супраселлярном росте опухоли нарушаются острота и поля зрения. Крупные опухоли, распространяющиеся в стороны, сдавливают кавернозные синусы и проходящие здесь III, IV, V и VI пары черепных нервов, что ведет к параличу внеглазничных мышц, диплопии, потере зрения. У больных с пролактиномой возрастает риск остеопороза, так как пролактин, подавляя секрецию кальцитонина, способствует деминерализации костной ткани.
Для диагностики используют гормональные и рентгенологические методы исследования. Как правило, в плазме крови больных определяются высокие уровни пролактина (более 2500–3000 мМЕ/л или 100 нг/мл – 500 нг/мл). Однако следует помнить, что встречаются случаи, когда при наличии опухоли уровень пролактина не превышает 50 нг/мл. При пролактиномах отсутствуют суточные колебания уровня пролактина, нет подъема, связанного со сном. Пробы с тиролиберином, метоклопрамидом или бромокриптином отрицательные.
Диагноз пролактиномы подтверждают с помощью КТ и МРТ. Опухоль обычно локализуется в боковых отделах гипофиза, часто смещает дно турецкого седла кпереди и книзу, что сопровождается истончением кортикального слоя кости.
При выявлении гиперпролактинемии и увеличении размеров турецкого седла следует определить уровень ТТГ, Т3 и Т4 для исключения первичного гипотиреоза.
Основными методами лечения являются хирургический, медикаментозный и лучевой.
Хирургическое лечение заключается в удалении транссфеноидальным доступом опухоли интраселлярной или растущей в сторону основной кости.
При использовании лучевой терапии восстановления менструальной функции часто не происходит. Может развиться гипопитуитаризм, связанный, по–видимому, с повреждением гипоталамуса.
Медикаментозное лечение заключается в назначении агониста дофамина – бромокриптина, парлодела, абергина, достинекса, норпролака, обладающих выраженным антипролиферативным влиянием на лактотрофы. Больные с пролактиномой подлежат диспансерному наблюдению. Один раз в год им проводится КТ, осмотр у окулиста, два раза в год – определение уровня пролактина.
Гипоталамическая и супрагипоталамическая аменорея – формы истинной патологической аменореи могут развиваться вследствие психонейроэндокринных расстройств, нарушений в системе нейротрансмиттеров, осуществляющих нервные связи между гипоталамусом и супрагипоталамическими центрами, и простагландинов на фоне приема некоторых препаратов; нарушений внутри гипоталамо–гипофизарного комплекса (воспалительные, опухолевые, травматические повреждения гипоталамуса).
Супрагипоталамические влияния играют важную роль в формировании целостности гипоталамо–гипофизарной системы и в реализации процессов психологической, социальной и физиологической адаптации. Функциональное состояние гипоталамуса неразрывно связано с активностью нейронов супрагипоталамической лимбической системы, поэтому нарушения этих структур, имеющих прямое отношение к регуляции настроения, эмоций и поведения, при действии стрессовых факторов (физических, эмоциональных и психосоциальных) приводят к резкому снижению секреции гонадотропинов и усилению выделения стрессорных гормонов гипофиза: АКТГ, гормона роста и пролактина.
Аменорея часто встречается при нервной анорексии. Это психонейроэндокринное состояние известно более двух столетий. Особенно распространено в западных странах. Частота его возросла в последние годы (от 1: 150 до 1:550 среди девочек–подростков и 1:90 у девушек старше 16 лет).
Нервная анорексия представляет собой стресс–синдром, при котором отмечается неспособность индивидуума психологически адаптироваться к конкретной обстановке, что проявляется патологическим отношением к еде.
В основе заболевания лежит повышение эндогенной опиоидной активности ЦНС, последствиями чего является активация гипоталамо–гипофизарно–надпочечниковой системы, торможение секреции гонадолиберина гипоталамусом, ингибирование норадренергической системы.
Активация гипоталамо–гипофизарно–надпочечниковой системы выражается в увеличении активности кортиколиберина, секреции АКТГ и возрастании количества и длительности эпизодов секреции кортизола. Это ведет к увеличению его среднесуточного уровня в плазме крови. Метаболизм кортизола и тестостерона замедлен, что связано с дефицитом гормонов щитовидной железы, особенно Т3. Отсутствие клинических проявлений избытка кортизола у больных с нервной анорексией объясняют уменьшением числа клеточных рецепторов глюкокортикоидов. Активность фермента 5а–редуктазы снижена, поэтому не происходит превращения тестостерона в дигидротестостерон, который действует на волосяные фолликулы. У больных отсутствуют выраженные проявления гирсутизма. Избыток кортиколиберина и снижение уровня катехоламинов в гипоталамусе могут подавлять потребление пищи и воды. Роль такого мощного фактора, ингибирующего потребление пищи, как кальцитонин, в патогенезе нервной анорексии неизвестна.
Нарушения в гипоталамо–гипофизарно–яичниковой системе выражаются в снижении амплитуды и частоты секреции гонадолиберина гипоталамусом и ЛГ гипофизом; нарушении реакции ФСГ и ЛГ на экзогенное введение гонадолиберина; приросте импульсной секреции ЛГ во время сна, как в препубертатном состоянии, что не является нормой для постпубертатного и зрелого возраста.
Снижение гонадотропной функции гипофиза приводит к нарушению функции яичников (отсутствию роста и созревания фолликулов, снижению секреции эстрадиола) и развитию аменореи. Уровень тестостерона у больных в пределах нормы.
Наиболее яркие проявления патологии – это соблюдение больными строжайшей диеты с навязчивым стремлением к похуданию, часто приводящему к резкому истощению, патологическая боязнь потерять контроль над приемом пищи и массой тела, чередующаяся с эпизодами переедания и искусственным вызыванием рвоты. Больные обычно принадлежат к семьям материально обеспеченным, но с деспотическими или безразличными родителями. В анамнезе у них возможны сексуальные покушения или инцест. Характерны чрезмерное, навязчивое самоутверждение, приводящее к прекрасной успеваемости, неправильная самооценка, непереносимость холода и тепла. Они могут быть агрессивны, сосредоточены на самих себе, плохо адаптируются к окружающей обстановке.
При осмотре выявляются снижение массы тела вплоть до полного истощения, низкая температура тела, брадикардия и снижение АД. Тело покрыто пушком. Молочные железы атрофичны, половое оволосение сохранено. Постоянный клинический признак – аменорея.
Из метаболических изменений у больных нервной анорексией отмечается снижение уровней глюкозы и инсулина натощак до нижней границы нормы, повышение числа инсулиновых рецепторов на эритроцитах, базальные уровни гормона роста. Почти у половины больных выявляют частичный несахарный диабет, обусловленный нарушениями гипоталамической регуляции секреции АДГ. Нарушений в электролитном балансе при этом может не быть.
Нарушение терморегуляции выражается в непереносимости как тепла, так и холода. У больных, как правило, отсутствует дрожь – гипоталамическая реакция, не зависящая от количества жировой ткани.
В тяжелых случаях возможен летальный исход на фоне гипокалиемического алкалоза.
Основу лечения составляют психоанализ, психотерапия, направленные на прекращение голодания, принудительного вызывания рвоты, поноса; изменение отношения к питанию, инструктаж членов семьи.
При уменьшении массы тела на 40% и более требуется принудительное парентеральное кормление. В менее тяжелых случаях рекомендуется высококалорийное питание дробными дозами в жидком виде до 6 раз в день.
Показано назначение витаминов А, В, С, седативных средств.
Имеются сведения о значительном увеличении массы тела на фоне внутривенной инфузии налоксона (3,2–6,4 мг/сут) – антагониста эндогенных опиоидов. Уже в течение 1–й недели лечения отмечаются положительные результаты. Эффективны также регуляторы дофаминергических систем (L–дофа – предшественника ДА) и антисеротонинергический препарат ципрогептадин.
После нормализации массы тела менструальная функция восстанавливается. Если этого не происходит, то назначается 2–3 курса циклической гормональной терапии эстрогенами и гестагенами. Восстановление фертильности достигается при использовании кломифена, гонадотропинов или гонадолиберина в пульсирующем режиме.
Психогенная (функциональная) аменорея – исчезновение менструаций у молодых женщин при отсутствии явных клинических нарушений в системе гипофиз – яичники – матка или других эндокринных системах. В настоящее время это один из наиболее распространенных типов аменорей.
Гипоталамическая аменорея психогенного типа обычно развивается у женщин, занятых интеллектуальным трудом, с предшествующими нарушениями менструальной функции, недостаточной массой тела, подвергающихся длительному воздействию стрессорных факторов, при применении седативных и снотворных средств. Важным в развитии патологии является степень восприимчивости больной и индивидуальная способность к адаптации. Прекращение менструаций у таких больных «отражает стремление природы предотвратить неблагоприятные воздействия внешней среды на плод в условиях, когда в организме потенциальной матери развиваются хронические реакции, направленные на ее собственное выживание» (C.C.K. Yen, R.B. Jaffe, 1998).
Нейроэндокринные нарушения при этой форме аменореи заключаются: в активации гипоталамо–гипофизарно–надпочечниковой системы в дневные часы; снижении частоты и/или амплитуды импульсной секреции гонадолиберина и гонадотропинов, что ведет к прекращению циклических процессов в яичниках и к аменорее; вероятном усилении ингибиторных влияний на секрецию гонадолиберина опиоидных пептидов и ДА. Иногда отмечается усиление импульсной активности ЛГ, связанное со сном. Это свидетельствует о том, что система гипоталамус – гипофиз – яичники регрессирует к препубертатному состоянию.
Характерно прекращение менструаций без предварительного периода их урежения. На фоне аменореи отсутствуют вегетативно–сосудистые нарушения («приливы», потливость и др.), свойственные климактерическому синдрому или синдрому истощения яичников.
В плазме крови отмечается снижение уровня гонадотропинов и половых стероидов до базальных значений.
Лечение должно начинаться с выявления анамнестических данных об отношениях с родителями, реакциях на окружающую среду, социальных и межличностных отношениях. Большую помощь оказывает психологическая поддержка. Если через 6–8 месяцев после психологической помощи не наступает спонтанное выздоровление, проводят заместительную терапию эстрогенами и гестагенами или кломифеном с целью индукции овуляции. Для восстановления репродуктивной функции при отсутствии эффекта от кломифена показано импульсное введение аналогов гонадолиберина.
Аменорея при физической нагрузке и потере массы тела возникает при чрезмерных физических нагрузках при занятиях различными видами спорта и снижении массы тела, связанном с использованием различных диет и ограничением питания.
Тяжесть нарушений репродуктивной системы зависит от продолжительности и интенсивности физической нагрузки или степени выраженности дефицита жировой ткани и массы тела. Так, например, у спортсменок, занимающихся бегом, или у балерин аменорея встречается чаще (у 40–50%), чем у занимающихся плаванием (около 12%). Снижение массы тела на 10–15% (что отражает потерю 30% жира) может вызвать аменорею.
В основе аменореи, связанной с физическими нагрузками и ограничением питания, лежит нарушение нейромедиаторного обмена в ЦНС, гипоталамической секреции гонадолиберина (снижение амплитуды и частоты пульсаций) и снижение импульсной секреции ЛГ, что вначале ведет к недостаточности лютеиновой фазы, ановуляции, затем к аменорее.
Вторичная аменорея может появляться, когда выраженного истощения еще нет. Возникновение аменореи зависит от исходной массы тела, скорости ее потери и индивидуальной реакции организма. Так, потеря массы тела у больных может колебаться от 5 до 31 кг (3–10%).
Мотивом для соблюдения диеты может быть стремление к достижению идеальной фигуры, стресс, критические замечания окружающих по поводу фигуры и т.д. Конфликты в семье усугубляют нарушение психики вплоть до развития нервной анорексии.
При осмотре отмечаются дефицит массы тела и подкожной жировой клетчатки, телосложение женского типа (при чрезменых физических нагрузках интерсексуальное), вторичные половые признаки развиты нормально. Уровень ЛГ, ФСГ и эстрадиола снижен.
Проба с аналогом гонадолиберина положительная.
Лечение должно быть направлено на уменьшение интенсивности физических нагрузок и нормализацию массы тела, что само по себе ведет к восстановлению менструальной функции. Возможно также применение циклической терапии микродозами эстрогенов с гестагенами в течение 3–6 месяцев. Восстановление репродуктивной функции достигается введением гонадолиберина в импульсном режиме или назначением кломифена.
Аменорея возникает при гиперпролактинемии (гиперпро–лактинемическом гипогонадизме). Под гиперпролактинемией понимают стойкое повышение уровня пролактина в плазме крови, превышающее верхнюю границу нормы (20 нг/мл или 600 ммЕ/л), не связанное с беременностью и лактацией. Гиперпролактинемия выявляется у 15–30% женщин с вторичной аменореей и почти у 50–70% – с бесплодием. Гиперпролактинемия может быть физиологической и патологической. Физиологическая гиперпролактинемия наблюдается во время беременности и в период лактации. Подъем уровня пролактина отмечается во время сна, после приема пищи, при стрессе, физической нагрузке, во время полового акта, в предовуляторном периоде и в лютеиновой фазе менструального цикла. Патологическая гиперпролактинемия развивается в результате анатомических или функциональных нарушений в системе гипоталамус – гипофиз. Органическими причинами гиперпролактинемии могут быть микро– и макропролактиномы, интра– и супраселлярные гормонально неактивные опухоли, синдром «пустого турецкого седла», травма ножки гипофиза.
Функциональная патологическая гиперпролактинемия чаще всего бывает связана с нарушением образования, доставки или взаимодействия пролактинингибирующего фактора дофамина (ДА) с лактотрофами гипофиза.
Клинические нарушения продукции пролактина могут быть связаны:
? с патологическим течением беременности, родов и послеродового периода (синдром Киари – Фроммеля)
? с приемом лекарств: фенотиазинов, бутирофенонов, метоклопрамида, блокаторов ДА–рецепторов; резерпина, альдомета, истощающих запасы катехоламинов; имипрамина (тофранила) и амфетамина, препятствующих обратному захвату ДА нервными окончаниями; опиатов, ингибиторов моноаминооксидазы (МАО)
? с использованием эстрогенов и комбинированных оральных контрацептивов, эстрогенный компонент которых, взаимодействуя с эстрогенчувствительным элементом гена пролактина, увеличивает его синтез и секрецию
? с травмами и оперативным вмешательством на грудной клетке; опоясывающим герпесом грудной клетки
? с некоторыми тяжелыми заболеваниями: почечной и печеночной недостаточностью, саркоидозом, гистиоцитозом Х, бронхогенным раком
? с частыми выскабливаниями стенок матки.
Гиперпролактинемия наблюдается при гипотиреозе, некоторых формах климактерического, предменструального синдромов и синдрома поликистозных яичников (СПКЯ), хроническом психогенном стрессе, акромегалии, болезни Иценко – Кушинга, а также при миоме матки, эндометриозе, воспалительных процессах, которые можно расматривать как состояние хронического эндогенного стресса.
Устранение действия пролактинингибирующего фактора (ДА) либо действие стимулирующих факторов (эстрогены, тиролиберин, серотонин, ГАМК) ведут к усилению образования и секреции пролактина с последующим угнетением секреции гонадолиберина, гонадотропной функции гипофиза, фолликуло– и стероидогенеза в яичниках. Кроме того, у 1/3 женщин с гиперпролактинемией обнаруживается усиление синтеза андрогенов в надпочечниках (ДЭА и ДЭА–С).
Функциональная форма гиперпролактинемии может сопровождаться галактореей в 30% случаев. Частота ее увеличивается до 70–96% при аменорее, связанной с пролактиномой гипофиза. Галакторея может наблюдаться на фоне ановуляции, овуляторного цикла и нормопролактинемии. Последнее может объясняться высокой биологической активностью пролактина и повышенной чувствительностью к нему рецепторов молочных желез. Нормальный уровень пролактина в крови определяется в связи с его низкой иммуннореактивностью.
Нарушения функции яичников могут проявляться недостаточностью лютеиновой фазы, ановуляцией, нерегулярными менструациями, олигоменореей и аменореей. Среди других клинических симптомов встречаются бесплодие, снижение полового влечения, ожирение, головные боли типа мигрени и др.
При осмотре выявляется умеренная гиперплазия молочных желез на фоне гипоэстрогенного состояния гениталий. Уровень пролактина в крови при функциональной гиперпролактинемии не превышает 1500–2000 ммЕ/л, уровни ЛГ, ФСГ, эстрадиола и тестостерона снижаются. У 30–40% больных увеличивается содержание надпочечниковых андрогенов – ДЭА и ДЭА–С. При проведении проб с тиролиберином, метоклопрамидом, бромокриптином отмечается умеренно положительная реакция.
Клиническим примером аменореи, обусловленной гиперпролактинемией, может служить синдром Киари – Фроммеля, или послеродовая аменорея–галакторея, возникающая после патологически протекающих беременности и родов. Характерными клиническими признаками синдрома являются аменорея, галакторея, атрофия половых органов. Заболевание часто сопровождается нарушением углеводного и липидного обмена, ожирением, психическими и неврологическими расстройствами. При гормональном обследовании выявляются повышенное содержание пролактина в плазме крови, снижение уровня ФСГ, низкое содержание эстрогенов, соответствующее ранней фолликулярной фазе цикла, и очень низкая концентрация прогестерона. Тесты функциональной диагностики свидетельствуют о выраженной гипоэстрогении: симптомы «зрачка» и «папоротника» отрицательные, шеечный индекс 1–3 балла, во влагалищном мазке парабазальные клетки достигают 20–50%, видны мелкие промежуточные клетки, КПИ менее 5%.
Для исключения опухоли гипофиза показаны КТ или МРТ черепа, консультация офтальмолога (исследование цветных и периферических полей зрения). При подозрении на гипофункцию щитовидной железы в плазме крови исследуется уровень ТТГ, Т3 и Т4.
Лечение функциональной гиперпролактинемии заключается в терапии основного заболевания и назначении агонистов ДА: бромокриптина (парлодела), метерголина (достинекса), квинаголида (норпролака), оказывающих тормозящее влияние на секрецию пролактина. Доза препаратов подбирается индивидуально под контролем уровня пролактина: от 1,25 до 7,5 мг/сут для парлодела; от 20 до 75 мкг/сут для норпролака и от 0,3 мг (1/2 таблетки) до 1,0 мг в неделю для достинекса. Общая продолжительность лечения – до 6 месяцев. Оптимальным считается снижение концентрации пролактина в плазме крови до 10 нг/мл. Клиническими критериями эффективности лечения являются исчезновение галактореи, восстановление овуляторных циклов (по данным базальной термометрии), наступление беременности. Если при приеме бромокриптина беременность не наступает, то лечение дополняют назначением кломифена и гонадотропинов.
При гиперпролактинемии, развившийся на фоне первичного гипотиреоза, показано лечение препаратами щитовидной железы (тиреоидином по 0,1 г; трийодтиронином по 20 мкг или тиреокомбом).






