Портальная гипертензия
Портальная гипертензия – это симптомокомплекс (синдром), развивающийся вследствие нарушения кровотока в портальной системе, ведущим признаком которого является повышение давления в воротной вене.
Историческая справка.
Понятие о портальной гипертензии ввели Gilbert (1901) и Villaret (1908). Вся история хирургического лечения больных портальной гипертензией тесно связана с расширением представления о ее причинах и патогенезе, т.е. в основном с циррозом печени. Первое научное описание цирроза печени (атрофического) привел Laennec (1819). Он же предложил термин "цирроз" (от греч, kirrhos – лимонно–желтый). А. Соловьев (1873) дал характеристику билиарного цирроза. Blakemore (1945), Linton (1945, 1947) выделили вне– и внутрипеченочный блоки портального кровотока. 8 случае развивающегося при циррозе печени нарушения портального кровотока Talma (1898) предложил подшивать большой сальник к брюшине, Н. В. Экк (1877) – накладывать прямой портокавальный анастомоз, Н. А. Богораз (1912) – формировать соустье между верхней брыжеечной и нижней полой венами, a Linton (1947) – между селезеночной и левой почечной веками. В. В. Подвысоцкий (1886), В. А. Меастер (1894), Islani с соавт. (1958) теоретически обосновали целесообразность выполнения при портальной гипертензии вследствие цирроза печени частичной резекции ее, электрокоагуляции, денервации печеночной артерии. В 1955 г. Welch в эксперименте произвел первую гетеротопическую, а в 1959 г. Мооr – ортотопическую пересадку печени. Sarzl с соавт. (1963) выполнили ортотопическую трансплантацию печени в клинике.
Классификация.
Исходя из уровня препятствия для оттока крови по системе воротной вены и характера вызвавшего его основного заболевания выделяют четыре формы синдрома портальной гипертензии: предпеченочную (допеченочную), внутрипеченочную, надпеченочную и смешанную.
Этиология.
Причины, лежащие в основе развития синдрома портальной гипертензии, разнообразны. Они подразделяются на врожденные и приобретенные. Так, нарушение тока крови по воротной вене (предпенсионная форма синдрома) в 80% случаев возникает при врожденных аномалиях развития этой вены и ее ветвей: аплазии (врожденное отсутствие вены), гипоплазии (недоразвитие вены), атрезии (один из концов вены заканчивается слепо), протяженных или локальных заращениях просвета вены. Приобретенными причинами окклюзии являются тромбозы и флебиты воротной вены при гнойно–септических заболеваниях, сдавление ее воспалительными инфильтратами, кистами, опухолями брюшной полости и забрюшинного пространства, рубцами.
Внутрипеченочная форма синдрома обусловлена различными видами цирроза печени (портального, постнекротического, билиарного, смешанного), хроническим гепатитом, очаговыми склеротическими и рубцовыми изменениями в ткани печени (опухоли, рубцы, посттравматический, поствоспалительный, портальный фиброз печени, рак и т.д.).
Врожденными причинами надпеченочной формы портальной гипертензии являются сужение, мембранозное заращение просвета нижней полой вены на уровне или проксимальнее впадения в нее печеночных вен. К приобретенным причинам относятся тромботическая окклюзия на этом уровне нижней полой вены, ее стеноз, сдавление опухолью, рубцами (синдром Бадда–Киари) и эндофлебит печеночных вен с их частичной или полной непроходимостью (болезнь Киари), цирроз Пика сердечного происхождения.
В основе развития смешанной формы синдрома лежит сочетание различных этиологических факторов, чаще всего цирроза печени с тромбозом воротной вены.
Патогенез.
Синдром портальной гипертензии развивается, как уже отмечалось, в результате длительного повышения давления в системе воротной вены. В норме через воротную вену в печень поступает 75% крови, а 25% – через печеночную артерию. Внутрипортальное давление составляет 120–180 мм вод. ст. и определяется объемом притекающей к печени крови, величиной давления в брюшной полости, перистальтикой кишечника и т.д. При возникновении затруднения для тока крови давление в портальной системе увеличивается. У лиц с внепеченочным блоком портальная гипертензия обусловлена чисто механической причиной. При внутрипеченочном блоке повышение давления носит первоначально компенсаторный характер, направленный на поддержание адекватного кровообращения в цирротически измененной печени. Одновременно при внутрипеченочной форме портальной гипертензии для повышения артериализации крови, поступающей в печень, усиливается артериальный приток к селезенке. Внутри ее образуются артериовенозные фистулы. В свою очередь увеличение притока артериальной крови ведет к ее гиперплазии (спленомегалии), а нередко и к гиперспленизму, который проявляется анемией, лейкопенией и тромбоцитопенией.
Длительное существование препятствия для тока крови, прогрессирующее увеличение давления в системе воротной вены, часто превышающего 200–400 мм вод. ст., сопровождается изменением характера портального кровообращения. Отток крови из системы осуществляется через портокавальные анастомозы. Ретроградному току крови способствует и отсутствие в портальной вене клапанов.
Основными путями коллатерального кровообращения являются:
1. Анастомозы в области кардиального отдела желудка и абдоминального отдела пищевода. По ним кровь из воротной вены через венечную и другие вены желудка, в основном расположенные по малой кривизне, вены нижней части пищевода, по непарной и полунепарной венам поступает в верхнюю полую вену. При отсутствии анастомозов между венами желудка и пищевода происходит изолированное расширение желудочных вен вследствие возникновения портопортальных или портокавальных анастомозов.
2. Анастомозы между верхними (системой воротной вены), средними и нижними прямокишечными венами (система нижней полой вены).
3. Анастомозы между околопупочными и пупочной венами. Кровь из воротной вены через пупочную поступает в вены передней брюшной стенки, а оттуда в нижнюю и верхнюю полые вены.
4. Анастомозы между венами желудочно–кишечного тракта и венами, отводящими кровь к забрюшинным и медиастинальным венам.
Вены, участвующие в формировании портокавальных анастомозов, варикозно расширяются, истончаются и нередко являются источниками пищеводных, желудочных и прямокишечных кровотечений.
Этому способствуют:
1. наблюдающееся у больных с циррозом печени нарушение синтеза в печени и селезенке многих факторов свертывающей системы крови и ингибиторов коагуляции (протромбин, фибриноген, проконвертин, гепарин, антифибринолизин и т.д.);
2. портальные кризы, сопровождающиеся значительными колебаниями давления в портальной системе. У лиц с варикозным расширением вен пищевода и кардиального отдела желудка в изъязвлении слизистой определенную роль играет кислотно–пептический фактор.
Прогрессирующее увеличение в портальной системе давления, повышение на этом фоне диффузии белковой части крови в свободную брюшную полость с одновре – менным снижением белково–синтезирующей функции печени, затруднение оттока лимфы от органов брюшной полости, увеличение в крови содержания антидиуретического гормона альдостерона, задержка в организме натрия приводят к появлению асцита.
Клиническая картина.
Наиболее типичными признаками портальной гипертензии являются спленомегалия, варикозное расширение вен пищевода, желудка, прямой кишки и кровотечения из них, асцит, диспептические проявления, печеночные знаки (сосудистые звездочки, печеночные ладони и др.), гиперспленизм, гипокоагуляция, неврологические расстройства. Характер течения портальной гипертензии, степень выраженности указанных симптомов и синдромов зависят от варианта портального блока. Так, по сравнению с внутрипеченочной формой синдрома клинические проявления внепеченочной локализации более однотипны. Симптомы врожденной пред– и надпеченочной форм портальной гипертензии появляются в детском возрасте. При приобретенной форме портального блока в анамнезе отмечаются гнойно–септические процессы. Первыми признаками нарушения кровотока по системе портальной вены нередко является спленомегалия или пищеводно–желудочное кровотечение. После кровотечения размеры селезенки уменьшаются. Больных беспокоят общая слабость, ноющие боли в левом подреберье. Синдром протекает в основном благоприятно. Асцит возникает редко в терминальной стадии портальной гипертензии.
Острая форма внепеченочного блока сопровождается интенсивными болями в эпигастрии и правом подреберье, гипертермией. При предпеченочном блоке быстро развиваются сштеномегалия и асцит, а при надпеченочной окклюзии – и гепатомегалия. Часто возникающие пищеводно–желудочные кровотечения и печеночно–почечная недостаточность нередко приводят к летальному исходу.
У больных с внутрипеченочной формой портальной гипертензии превалируют проявления цирроза печени (алкогольного, постнекротического и т.д.). Помимо слабости, головной боли, повышенной утомляемости, чувства тяжести и болей в животе, диспептических расстройств, наблюдаются похудание, сухость и бледность кожных покровов, печеночные знаки, повышенная кровоточивость, увеличение живота (за счет гепатомегалии, спленомегалии, атонии кишечника). Пищеводно–желудочные и ректальные кровотечения, гиперспленизм приводят к анемии. В поздних стадиях появляются желтуха и асцит.
В зависимости от степени выраженности типичных признаков портальной гипертензии, состояния портопеченочного кровотока выделяют три стадии клинического течения синдрома портальной гипертензии (М. Д. Пациора):
1. компенсированную (начальную) – характеризуется умеренным повышением портального давления, компенсированным внутрипеченочным кровообращением, спленомегалией с гиперспленизмом или без него;
2. субкомпенсированную – отмечаются высокое портальное давление, спленомегалия, варикозное расширение вен пищевода и желудка с кровотечением или без кровотечения из них, значительные нарушения в портопеченочном кровообращении;
3. декомпенсированную – имеют место спленомегалия, варикозное расширение вен пищевода и желудка с кровотечением или без кровотечения из них, асцит, выраженные нарушения в портопеченочном и центральном кровообращении.
Диагностика.
При внепеченочной врожденной форме портальной гипертензии обращают на себя внимание бледность кожных покровов пациентов, увеличение и асимметрия живота за счет спленомегалии. Селезенка значительно увеличивается, имеет неровную поверхность, ограниченную подвижность из–за выраженного периспленита. Изменения в печени слабо выражены, она подвижна, с гладкой поверхностью. В крови отмечаются умеренная анемия, лейкопения и тромбоцитопения.
Для внутрипеченочной формы портального блока характерно наличие дефицита массы тела, печеночных знаков, развитой коллатеральной венозной сети на передней брюшной стенке. Состояние печени определяется этиологическим фактором портального блока. Селезенка плотная, безболезненная, в случае отсутствия периспленита смещается при пальпации. В крови выявляется гипопротеинемия, увеличиваются показатели, свидетельствующие о нарушении антитоксической функции печени, повышается активность трансаминаз. Часто возникает олигурия.
В диагностике портальной гипертензии особую роль играют лабораторно–инструментальные методы обследования.
По данным бромсульфалеиновой пробы, определения содержания в крови трансаминаз, щелочной фосфатазы, ЛДГ, пигментного и углеводного обмена устанавливают степень изменения функционального состояния печени.
При фиброгастроскопии выявляют варикозное расширение вен подслизистого слоя пищевода и кардиального отдела желудка. Расширенные вены выбухают в просвет в виде нескольких стволов, соединенных между собой более мелкими венозными сплетениями.
Рентгенологически просвет пищевода в области варикозно расширенной вены дилатирован, имеет нечеткие контуры, множественные дефекты наполнения.
Во время рекгороманоскопии выявляют варикозно расширенные геморроидальные вены.
Спленоманометрия позволяет определить уровень портального давления.
На основании спленопортографии, целиакографии, каваграфии, трансумбиликальной портогепатографии, прямой портографии получают информацию об уровне портального блока. В непораженной портальной системе на спленопортограммах определяется депо контрастного вещества в селезенке. Хорошо контрастируются селезеночная и воротная вены, вены 5–6–го порядка последней. При целиакографии наблюдается заполнение контрастом селезеночной, печеночной артерий и их внутриорганных ветвей, при каваграфии – беспрепятственное распространение контраста по нижней полой вене. На трансумбиликальной и прямой партограммах четко выявляются сосуды печени, внутри– и внепеченочные анастомозы. Типичными рентгенологическими признаками внутрипеченочной формы портальной гипертензии являются расширение v.portae и ее притоков, слабое контрастирование внутрипеченоч – ных сосудов. Нередки внутрипеченочная деформация и заполнение контрастным веществом варикозно расширенных коллатералей. При предпеченочной форме находят участки тромботической окклюзии воротной или селезеночной вены, а при надпеченочной – сужение (окклюзию) нижней полой вены в области или проксимальнее впадения в нее печеночных вен.
Причина возникновения портальной гипертензии уточняется на основании чрескожной пункционной биопсии печени в IX–X межреберье справа по средненодмышечной линии в состоянии апноэ специальной иглой (Сильвермана, Шиба) или во время лапароскопии.
Лечение.
Консервативное лечение больных портальной гипертензией малоэффективно, но оно крайне необходимо при кровотечении из варикозно расширенных вен пищевода и желудка. При пищеводно–желудочном кровотечении проводят общую и местную гемостатическую терапию. Общая гемостатическая терапия предполагает внутривенное введение 20 мл 10% раствора кальция хлорида, 100–200 мл 5 % раствора ?–аминокапроновой кислоты (для уменьшения фибринолитической активности крови), 2–4 г фибриногена, внутримышечно назначается викасол (1–3 мл 1% раствора). Исходя из показателей гемодинамики возмещают объем циркулирующей крови (цельная кровь, препараты крови, кровезаменители, кристаллоидные растворы и т.д.). Эффективно внутривенное введение питуитрина, снижающего портальное давление: 0,3 ЕД/кг препарата в 200 мл 5 % раствора глюкозы переливают внутривенно капельно за 20 мин. Через 40–60 мин вводят поддерживающую дозу – 0,1 ЕД/кг в 100 мл 5 % раствора глюкозы за 10 мин с последующей инфузией препарата в течение 6–12 ч из расчета 0,1 ЕД/кг в час.
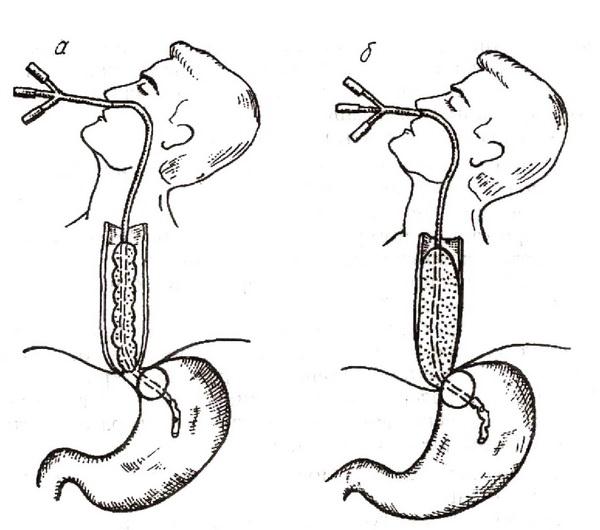
Местное лечение включает локальную гипотермию (холод на эпигастральную область и нижнюю треть передней поверхности грудной клетки, глотание льда), введение в пищевод зонда Сенгстейкина–Блейкмора. Зонд представляет собой трехпросветную резиновую трубку с двумя баллонами (рис. 25). Круглый баллон (объемом 60–70 мл) расположен на конце зонда, цилиндрический (объемом 100–150 мл) – несколько проксимальнее. Два канала зонда используются для раздувания баллонов, а третий, сообщающийся с просветом желудка, – для контроля эффективности гемостаза. После введения зонда через нос в желудок вначале раздувается дистальный баллон. Вслед за этим зонд подтягивается кверху. При соприкосновении баллона с кардией ощущается легкое сопротивление. Нагнетанием воздуха в пищеводный баллон достигается сдавление варикозно расширенных вен. Длительность пребывания зонда в пищеводе не должна превышать 48 ч в связи с реальной опасностью развития пролежней. Эффективность сдавления кровоточащих вен контролируется при ослаблении давления в баллонах.
Рис. 25. Остановка пищеводного кровотечения с помощью зонда Сенгстейкина–Блейкмора:
а – раздутая манжетка в желудке; б – раздутая манжетка в пищеводе.
Для остановки кровотечения из вен пищеводно–кардиальной области применяется и эндоскопический трансэзофагеальный гемостаз. Он достигается интравенозным (интравазальным) или паравазальным введением склерозирующих препаратов (тромбовар, варикоцид, этоксисклерол, этиловый спирт и т.д.), а также интравазальным введением эмболизирующих веществ. Последние представляют собой изначально плотные или полимеризующиеся после внутрисосудистого введения соединения (синтетические гели, препараты тромбина, желатина, цианокрилаты). Интравенозные инъекции склерозирующих препаратов вызывают выраженную деструкцию вен, способствуя быстрой облитерации просвета и остановке кровотечения. Паравазальное введение стимулирует разрастание соединительной ткани в подслизистом слое пищевода, снижая вероятность формирования новых варикозных узлов.
Хирургическое лечение показано:
1. при кровотечении из варикозно расширенных вен пищевода и желудка, не останавливающемся от проводимого консервативного лечения;
2. при варикозном расширении вен пищевода и желудка, часто осложняющемся кровотечением;
3. при спленомегалии с гиперспленизмом;
4. при асците;
5. для коррекции портального кровотока при отсутствии грубых морфофункциональных изменений в состоянии печени и селезенки; уровне билирубина в крови ниже 34 мкмоль/л, содержании альбумина выше 0,35 г/л, если нет асцита, гиперспленизма, неврологических расстройств.
Операция противопоказана:
1. при значительных морфофункциональных изменениях в печени;
2. при тяжелой сопутствующей патологии.
Хирургическое лечение в подавляющем большинстве случаев осуществляется планово, после соответствующей медикаментозной терапии. При кровотечении из варикозно расширенных вен пищевода и желудка операция нередко выполняется экстренно.
Выбор способа оперативного вмешательства определяется индивидуально, исходя из результатов прежде всего рентгенологического исследования портальной системы (уровня блока, состояния сосудистой сети), а также тяжести гиперспленизма, степени компенсации нарушенных функций печени, наличия сопутствующих заболеваний, возраста и общего состояния больных.
Многочисленные операции, используемые при портальной гипертензии, подразделяются на пять групп:
1. Направленные на предотвращение связи вен желудка и пищевода с венами портальной системы (операции разобщения). Выполняются в случае значительного коллатерального сброса, выраженного расширения вен кардиоэзофагеальной области.
К ним относятся:
? операция Пациоры – гастротомия косым разрезом от дна к малой кривизне желудка с прошиванием расширенных вен желудка и пищевода со стороны слизистой.
Наиболее эффективная операция. Может сочетаться с перевязкой селезеночной артерии и пересечением ее по верхнему краю поджелудочной железы;
? операция Таннера – поперечное пересечение желудка в кардиальном его отделе с последующим сшиванием стенок;
? операция Крзйля – эзофаготомия и непосредственное прошивание измененных вен пищевода. При сбросе крови по венечной и коротким венам желудка производится их изолированная перевязка на протяжении.
2. Направленные на создание новых путей оттока крови из портальной системы. Эти операции подразделяются на две подгруппы: сосудистых и органоанастомозов (оментопексий и органопексий).
Формирование сосудистых анастомозов (портокавальное шунтирование) – единственный радикальный способ уменьшения давления в системе v.portae. Это достаточно сложные операции. Их эффективность зависит от функционального состояния печени и селезенки к моменту хирургического вмешательства. Недостатками операций являются тромбоз анастомозов, гастродуоденальные изъязвления и рецидивы кровотечений. Кроме того, портокавальное шунтирование сопровождается уменьшением обезвреживания крови в печени. Это ведет к тому, что при формировании анастомоза между портальной и нижней полой венами в 25–50% случаев развивается токсическая энцефалопатия и печеночная кома с летальностью 20–40%. Из группы шунтирующих операций предпочтение отдается спленоренальному (операция Уиппла–Блейкмора) и кавомезентериальному анастомозам (операция Богораза).
Органоанастомозы рассчитаны на улучшение оттока крови из портальной системы за счет формирования сращений между сальником и окутываемым им органом (оментопексия) или между органами вследствие существования градиента давления по разные стороны от места блока (органопексии). При органопексиях сосудистые анастомозы (сращения) образуются между органами брюшной полости или при перемещении органов брюшной полости в другие анатомические области (операции перемещения).
К оментопексиям относятся оментогепатопексия, оментоспленопексия, оментонефропексия (применяются наиболее часто), оментогепатодиафрагмопексия, оментоплевропексия. Как правило, оментопексии дополняются другими вариантами хирургических вмешательств.
Органопексии включают: гепатопневмопексию – иссечение части правого купола диафрагмы с подшиванием нижней поверхности правого легкого к печени; гастропексию – подшивание к декапсулированной левой доле печени серозно–мышечного лоскута малой кривизны или передней стенки желудка; кологепатопексию – подшивание к декапсулированной правой доле печени демукозированного сегмента поперечной ободочной кишки на сосудистой ножке.
К операциям перемещения относятся перемещение в плевральную полость более ? массы правой доли печени; перемещение декапсулированной селезенки в забрюшинное пространство, в плевральную полость и т.д.; перемещение сальника в подкожно–жировую клетчатку, во влагалище прямой мышцы живота, в плевральную полость.
3. Направленные на отведение асцитической жидкости из брюшной полости: лапароцентез, операция Кальба, перитонеовенозное шунтирование, торакализация декапсулированной печени.
Операция Кальба предполагает создание постоянного дренажа брюшной полости путем иссечения участков париетальной брюшины и брюшных мышц до подкожной клетчатки в области поясничных треугольников кнаружи от восходящей и нисходящей толстой кишки.
При перитонеовенозном шунтировании (операция Рюотта) большая подкожная вена бедра выделяется на протяжении 10–15 см от впадения в бедренную, пересекается и вшивается над пупартовой связкой в отверстие в брюшине. Асцитическая жидкость отводится непосредственно в сосудистое русло. Операция широко не применяется из–за частой облитерации вен.
Сущность тораколизации декапсулированной печени заключается в резекции правого купола диафрагмы и перемещении декапсулированной печени в плевральную полость на границе грудной и брюшной полостей. Развивающееся в раннем послеоперационном периоде вследствие брюшно–плевральной разницы в давлении усиление кровообращения в печени, а вместе с этим и ее метаболизма приводит к исчезновению асцита в ближайшие 10–15 дней.
Уменьшению асцита способствуют операции, улучшающие лимфоотток из брюшной полости: а) формирование лимфовенозных анастомозов (на шее – между шейной частью лимфатического протока и яремной или подключичной веной, под диафрагмой – между брюшной частью коллектора, образующего грудной лимфатический проток, и нижней полой веной); б) наружное дренирование грудного лимфатического протока. Однако последняя операция приводит к большой потере белка, жидкости, что способствует олигурии. Для закрытия дефекта в стенке протока нередко требуется повторное вмешательство.
4. Направленные на уменьшение притока крови в портальную систему: спленэктомия, перевязка артерий и вен (левой желудочной и правой желудочно–сальниковой артерий, нижней брыжеечной вены, печеночной артерии, селезеночной и т.д.), рентгеноэндоваскулярная окклюзия печеночной артерии. Наиболее распространенной операцией данной группы является спленэктомия. Основными показаниями к ее выполнению служат гиперспленизм и изолированный тромбоз селезеночной вены. Необоснованное удаление селезенки у больных с синдромом портальной гипертензии сопровождается рецидивом кровотечений, так как снижает давление в портальной системе только на 40–100 мм рт. ст. Кроме того, разрушение в результате операций сети коллатеральных сосудов нередко способствует замедлению оттока крови с последующим венозным тромбозом в портальной системе. Не исключается и развитие в послеоперационном периоде серьезных отклонений в состоянии иммунной системы.
5. Преследующие цель – усилить регенерацию печени и улучшить внутрипеченочное артериальное кровообращение: резекция печени (10–15% массы), периартериальная неврэктомия общей печеночной артерии (операция Малле–Ги), артериопортальные анастомозы (аортопортальный, спленопортальный, силеноумбиликальный), электрокоагуляция печени и т.д.
В большинстве случаев при хирургическом лечении больных портальной гипертензией выполняется несколько операций разных групп. Перспективным направлением в коррекции портального кровотока при поражении печени является ее пересадка.
В послеоперационном периоде проводится комплексное консервативное лечение, преследующее цель – улучшить функциональное состояние печени, общую и местную гемодинамику и т.д.
Летальность после операции у больных с синдромом портальной гипертензии колеблется от 20 до 50%.