Демпинг–синдром
Ранний демпинг–синдром (демпинг–синдром, синдром сбрасывания). Встречается в 10–30% случаев.
Патогенез.
Для объяснения механизма развития демпинг–синдрома разработаны механическая, нервно–рефлекторная, гуморальная, осмотическая, гипогликемическая, химическая, электролитная теории и теория функциональной недостаточности надпочечников. Общим их недостатком является односторонняя интерпретация развивающихся изменений в организме больных.
Патофизиология демпинг–синдрома связана с наличием нескольких факторов, реализующих свое влияние на фоне нарушения функционального состояния системы гипофиз – кора надпочечников и нервно–психических расстройств. Прежде всего разрушение клапанного аппарата привратника, формирование нового желудочно–кишечного соустья сопровождаются ускоренным опорожнением культи желудка от пищевых масс, стремительным их продвижением по тонкой кишке. Это приводит к быстрому ферментативному гидролизу пищеварительных веществ, повышению осмотического давления в просвете кишки. Вследствие выравнивания осмолярности во вне– и внутриклеточных пространствах внеклеточная жидкость перемещается в просвет кишки. Кишечная стенка растягивается. Одновременно выделяются вазоактивные амины: гистамин, серотонин, кинины, вазоактивный интестинальный полипептид и др. Происходит вазодилатация. Изменяется внутри– и внешнесекреторная функция поджелудочной железы. Наблюдается гипергликемия, сменяющаяся гипогликемией. В секрете поджелудочной железы снижается концентрация ферментов. Уменьшение ОЦК сопровождается тахикардией, общей слабостью, головокружением, обмороками, вначале падением, а затем повышением АД. Появляются ранние вазомоторные синдромы: тошнота, диарея. Пищевые массы подвергаются неполному перевариванию. Постепенно больные истощаются.
Клиническая картина.
У больных с демпинг–синдромом сразу же после еды (особенно после употребления сладких и молочных блюд) появляются резкая слабость, потливость, головокружение, приступы жара во всем теле, головная боль, сердцебиение, боль в области сердца, шум в ушах, ухудшение зрения, мышечная слабость. Отмечаются урчание, режущая боль в животе, часто завершающаяся профузным поносом. В зависимости от выраженности клинических синдромов выделяют три степени (формы) тяжести демпинг–синдрома: легкую, среднюю и тяжелую.
При легкой степени демпинг–синдром появляется вскоре после употребления только сладких и молочных блюд. Он продолжается 15–30 мин. Интенсивность клинических симптомов незначительная. Пульс учащается на 15 ударов в минуту. Масса тела остается нормальной, но иногда отмечается ее дефицит, не превышающий 5 кг. Трудоспособность больных не нарушается.
У больных с демпинг–синдромом средней тяжести выраженные клинические симптомы возникают после употребления любой пищи 2–4 раза в неделю. Они длятся 45–60 мин. В разгар приступа больные вынуждены ложиться. Пульс учащается на 20–25 ударов в минуту. АД имеет тенденцию к повышению в основном за счет систолического давления. Дефицит массы тела достигает 10 кг. Нарушается функция поджелудочной железы. У некоторых больных возникают нервно–психические расстройства. Трудоспособность снижается.
Демпинг–синдром тяжелой степени характеризуется появлением тяжелой реакции после употребления любой пищи. Продолжительность его составляет 1,5–3 ч. В течение этого промежутка времени больные вынуждены находиться в горизонтальном положении. В момент приступа пульс увеличивается более чем на 30 ударов в минуту. Повышается систолическое и снижается диастолическое давление. В ряде случаев отмечаются брадикардия, гипотония. Прогрессируют нервно–психические расстройства, прежде всего астенический синдром.
Для предупреждения приступов больные ограничивают количество пищи, что приводит к значительной белково–витаминной недостаточности, нарушению минерального обмена. Дефицит массы тела составляет более 10 кг. Трудоспособность утрачивается.
Диагностика.
Демпинг–синдром имеет достаточно характерные клинические проявления, которые подтверждаются провокацией его различными пищевыми нагрузками, данными рентгенологического и эндоскопического методов исследования.
Провокационный тест чаще всего проводится со 150 мл 50% раствора глюкозы, которую больной выпивает. Объективизация теста проводится по регистрации в течение последующего часа жалоб больных, динамики пульса, АД, записи на 30–й минуте ЭКГ. У больных с тяжелым демпинг–синдромом нормализация изучаемых показателей происходит спустя 1–1,5 ч после их возникновения.
Рентгенологическое исследование желудка и кишечника у лиц с подозрением на наличие демпинг–синдрома чаще проводится с водной взвесью бария сульфата. Однако более приближенные к реально существующим показатели нарушения моторно–эвакуаторной функции желудочнокишечного тракта получаются при использовании рентгеноконтрастной пищевой смеси.
К типичным рентгенологическим признакам демпинг–синдрома относятся:
1. быстрое опорожнение культи желудка от принятой бариевой взвеси;
2. значительное усиление перистальтики тонкого и толстого кишечника, сменяющееся инертностью;
3. провал первой ? или ? порции контрастной взвеси из желудка в тощую кишку в течение 1–2 мин с более длительной эвакуацией оставшейся части контраста;
4. неравномерность тонуса тонкого кишечника;
5. признаки энтерита, чаще в начальном или дистальном отделе тощей и подвздошной кишок.
Эндоскопическими признаками демпинг–синдрома являются широкое (более 2,5 см) гастроеюнальное или гастродуоденальное соустье, наличие в культе желудка повышенного количества тонкокишечного содержимого, дуоденогастральный или гастроеюнальный рефлюкс в момент выполнения фиброгастроскопии.
Лечение.
При демпинг–синдроме оно комплексное, дифференцированное с учетом тяжести демпинг–реакции. Значительное улучшение состояния больных с тяжелой или средней степенью синдрома, практически полное купирование приступов при легкой форме достигаются при консервативном лечении.
Оно включает:
1. диетотерапию;
2. проведение заместительного лечения;
3. снижение моторно–эвакуаторной функции желудочно–кишечного тракта;
4. уменьшение вегетативных реакций на поступление пищи;
5. общеукрепляющую
6. психоневрологическую терапию.
Пища должна состоять в основном из высококалорийных белковых и жировых продуктов, содержать небольшое количество углеводов. Пища принимается в прохладном виде, небольшими порциями, до 6 раз в день, в положении лежа, раздельно жидкая и плотная. При демпинг–синдроме используется и сухоедение. Заместительная терапия включает препараты, улучшающие переваривание и всасывание пищи.
Для снижения моторно–эвакуаторной функции желудочно–кишечного тракта перед употреблением пищи перорально назначаются холиноблокаторы (атропина сульфат), ганглиоблокаторы (гексоний, пипольфен и т.д.). Уменьшению интенсивности реакции после приема пищи способствуют антигистаминные вещества (димедрол, супрастин), антагонисты серотонина (резерпин), инсулин (вводимый подкожно).
Общеукрепляющее лечение включает массивную и длительную витаминотерапию (витамины группы В, С и др.); введение препаратов железа и других микроэлементов; переливание крови, плазмы, белковых гидролизатов, протеина, альбумина.
Для уменьшения болевого синдрома применяются двусторонняя паранефральная навокаиновая блокада (повторно 4–5 раз с интервалом в 3–5 дней), блокада левого чревного нерва.
Показания к хирургическому лечению возникают в случае отсутствия эффекта от консервативного лечения, что чаще всего наблюдается:
1. при тяжелой степени демпинг–реакции;
2. при сочетании демпинг–синдрома средней тяжести с синдромом приводящей петли, прогрессирующим истощением и болевой формой хронического панкреатита.
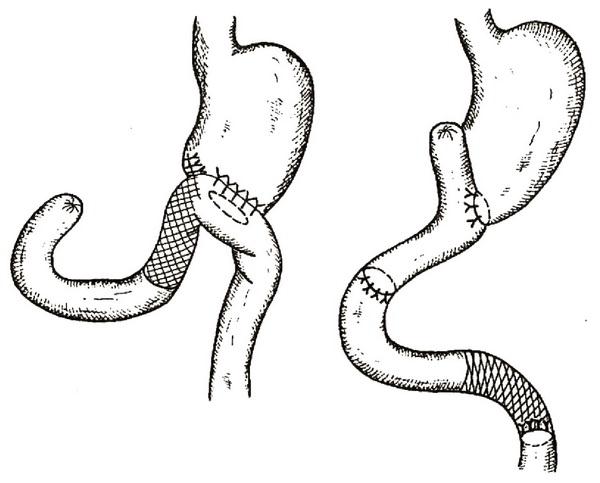
Рис. 10. Реконструктивная гастроеюнодуоденопластика по Захарову–Хенли.
Для хирургической коррекции демпинг–синдрома разработано несколько типов операций.
1. Реконструкция гастроеюнального анастомоза с включением в процесс пищеварения двенадцатиперстной кишки (редуоденизация двенадцатиперстной кишки посредством тонко– или толстокишечной вставки). Из этой группы операций наибольшее распространение получила гастроеюнодуоденопластика по Захарову–Хенли (рис. 10). Сущность операции заключается в трансплантации между культей желудка и двенадцатиперстной кишкой отводящей петли тонкого кишечника. В послеоперационном периоде вследствие замедления опорожнения желудка и восстановления порционной эвакуации желудочного содержимого в двенадцатиперстную кишку нормализуются продвижение пищи по кишечнику и ее переваривание. Меньшее распространение получили реконструкции желудочно–еюнального или желудочно–дуоденального анастомоза с применением антиперистальтическях кишечных сегментов.
2. Реконструкция желудочно–кишечных анастомозов типа Бильрот–II в анастомоз типа Бильрот–I. Операция не всегда технически осуществима.
3. Ваготомия, преимущественно стволовая, приводит к снижению двигательной активности желудка и кишечника. Применяется в сочетании с реконструктивными вариантами операции, так как восстановление пассажа пищи по двенадцатиперстной кишке сопровождается повышением кислотоферментообразующей функции желудка с последующим образованием пептической язвы.
4. Денервация начальных отделов петель тонкой кишки. Исчезновение или ослабление демпинг–реакции после хирургического лечения отмечается у 80–95% больных.